

| A����Ϊ�Ȼ��ϡ��ʱpHֵ�仯���ߣ�a��ˮ�ĵ���̶ȴ���c��ˮ�ĵ���̶� |
| B��b����Һ��ˮ�ĵ���̶ȱ�c����Һ��ˮ�ĵ���̶ȴ��������KW��ͬ |
| C��a��ʱ�������������Һ��NaOH��Ӧ���ĵ�NaOH����ͬ |
| D����������NaOH��b����Һ���ĵ�NaOH��d����Һ���ĵĶ� |
 NH3��H2O��H����ϡ�ʹٽ�ˮ�⣬�����ӵ����ʵ������ӣ������ӵ�Ũ�Ȼ��Ǽ�С�ģ���������Ũ�ȵı仯��ҪС��������������Ũ�ȵı仯�����������ߢ�Ϊ�Ȼ��ϡ��ʱpHֵ�仯���ߣ�a��ˮ�ĵ���̶ȴ���c��ˮ�ĵ���̶ȣ�A��ȷ������I��ʾ����ϡ��ʱpHֵ�仯���ߡ�������ǿ�ᣬ����ˮ�ĵ��룬�Ȼ��ˮ��ٽ�ˮ�ĵ��룬��b����Һ��ˮ�ĵ���̶ȱ�c����Һ��ˮ�ĵ���̶�С��B����ȷ��a��ʱ�������������Һ��NaOH��Ӧ���ĵ�NaOH������ͬ���Ȼ�����ĵĶ࣬C����ȷ��b��d�����Ȼ�������ʵ�����ȣ����Լ�������NaOH��b����Һ���ĵ�NaOH��d����Һ���ĵ���������һ���࣬D����ȷ����ѡA��
NH3��H2O��H����ϡ�ʹٽ�ˮ�⣬�����ӵ����ʵ������ӣ������ӵ�Ũ�Ȼ��Ǽ�С�ģ���������Ũ�ȵı仯��ҪС��������������Ũ�ȵı仯�����������ߢ�Ϊ�Ȼ��ϡ��ʱpHֵ�仯���ߣ�a��ˮ�ĵ���̶ȴ���c��ˮ�ĵ���̶ȣ�A��ȷ������I��ʾ����ϡ��ʱpHֵ�仯���ߡ�������ǿ�ᣬ����ˮ�ĵ��룬�Ȼ��ˮ��ٽ�ˮ�ĵ��룬��b����Һ��ˮ�ĵ���̶ȱ�c����Һ��ˮ�ĵ���̶�С��B����ȷ��a��ʱ�������������Һ��NaOH��Ӧ���ĵ�NaOH������ͬ���Ȼ�����ĵĶ࣬C����ȷ��b��d�����Ȼ�������ʵ�����ȣ����Լ�������NaOH��b����Һ���ĵ�NaOH��d����Һ���ĵ���������һ���࣬D����ȷ����ѡA��

 �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д� ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
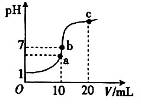
| A����b�㣬�����백ˮǡ����ȫ�к� |
| B����b�㣺c��H+��=c��OH-����c��NH4+��=c��Cl���� |
| C����a�㣺c��Cl����> c��NH4+��> c��H+��> c��OH-�� |
| D����c�㣺c��NH4+��+ c��NH3��H2O��="2" c��Cl���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c(NH4+)��ȵ�(NH4)2SO4��(NH4)2Fe(SO4)2��NH4Cl��Һ�У�����Ũ�ȴ�С��ϵ�ǣ� c[(NH4)2Fe(SO4)2]��c[(NH4)2SO4]��c(NH4Cl) |
| B����0.3 mol/L HY��Һ��0.3 mol/L NaOH��Һ�������Ϻ���Һ��pH=9���� c(OH��)��c(HY)=c(H+)=1��10��5mol/L |
| C��0.2mol��L��1 HCl��Һ������0.05 mol��L��1 Ba(OH)2��Һ��Ϻ���Һ��pH=1 |
| D��NaHCO3��Һ�У�c(H+)+c(H2CO3)=c(CO32��)+c(OH��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ˮ�������c��H+��=1.0��10��12mol��L��1 |
| B����ˮϡ�ͺ���Һ���������ӵ�Ũ�Ⱦ����� |
| C��2c��H+��= c��SO42����+ c��OH���� |
| D���μ�ϡ��ˮʹpH=7����c��NH4+��=" 2" c��SO42���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢ۢ� | B���٢� | C���ڢ� | D���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������£�pH=1����Һ�У� Na����Fe3����NO3����I�� |
| B��ˮ�����H��Ũ��Ϊ1��10��13mol��L��1����Һ�У�K����Al3����Cl����SO42�� |
| C��AlO2?Ũ��Ϊ0.1 mol��L-1����Һ�У� Na����K����HCO3����Cl�� |
| D������KSCN��Һ�Ժ�ɫ����Һ��K+��NH4+��Cl����NO3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��11��1 | B��9��1 | C��1��11 | D��1��9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��1:10:10 :10 :10 | B��1:5:5��10 :5��10 :5��10 |
C��1:20:10 :10 :10 | D��1:10:10 :10 :10 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com