
| 滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
| c(标准)×V(标准) |
| V(待测) |
| 0.8g |
| 1.00g |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、反应①的平衡常数K1=
| ||
B、反应③的平衡常数K=
| ||
| C、对于反应③,恒容时,温度升高,H2浓度减小,则该反应为吸热反应 | ||
| D、对于反应③,恒温恒容下,增大压强,H2浓度一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
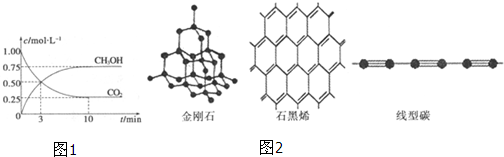
 温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2厂生成CH3OH:CO2(g)+3H2(g)
温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2厂生成CH3OH:CO2(g)+3H2(g)
| ||
| A、在前3分钟内v(H2)=10molL-1min-1 |
| B、在3分钟时CO2和CH3OH浓度相等,反应达到平衡 |
| C、在前15分钟内平衡常数K随CO2减少而逐渐减小 |
| D、在前15分钟时向设备中充入CO2和H2各10mol以提高H2转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaA溶液中c(Na+)-c(A-)=10-6mol?L-1 |
| B、NaB溶液中c(H+)+c(HB)=10-2mol?L-1 |
| C、将两溶液混合,混合溶液中:c(OH-)>5×10-3mol?L-1 |
| D、两溶液中的离子总数不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
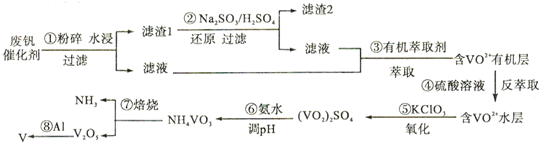
查看答案和解析>>
科目:高中化学 来源: 题型:
 滴定法是一种用于测定的非常重要的方法.
滴定法是一种用于测定的非常重要的方法.查看答案和解析>>
科目:高中化学 来源: 题型:
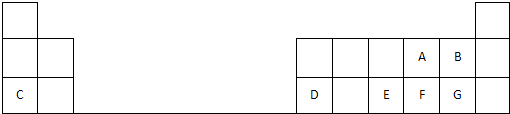
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
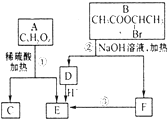 已知当一个碳原子上连有两个羟基时,易发生下列转化:
已知当一个碳原子上连有两个羟基时,易发生下列转化: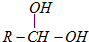
| H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com