
【题目】(1)已知下列物质在20℃下的Ksp如下,试回答下列问题:
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 货色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
①20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是______________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时 =_____________。
=_____________。
③测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是_______。
A.KBr B.KI C.K2S D.K2CrO4
(2)已知25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。
①在25℃下,向浓度均为0.1mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成____沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×10-5mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中 (填“还含有”或“不含有”) Al(OH)3,并请写出计算过程。
③根据25℃时Mg(OH)2的Ksp,计算该温度下反应Mg(OH)2+2H+![]() Mg2++2H2O的平衡常数K=________。
Mg2++2H2O的平衡常数K=________。
【答案】 Ag2CrO4>AgCl>AgBr>AgI>Ag2S 3×10-3 D Al(OH)3 不含有,Fe3+完全沉淀时,c3(OH-)=4.0×10-33,c(Al3+)·c3(OH-)=8×10-34<Ksp[A1(OH)3],所以没有生成Al(OH)3沉淀
【解析】试题分析:(1) ①根据五种银盐的Ksp,分别计算饱和溶液中Ag+物质的量浓度;②根据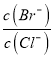 =
=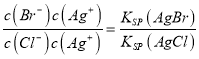 计算;③指示剂的作用是指示出氯离子恰好沉淀完全,即让氯离子先沉淀,沉淀完全后,再滴入硝酸银溶液会生成一种颜色不同的沉淀来指示沉淀终点;(2)①根据Ksp[Al(OH)3]、Ksp[Cu(OH)2]分别计算开始生成氢氧化铝和氢氧化铜沉淀需要氢氧根离子的浓度,氢氧根离子浓度小的先沉淀;②计算Fe3+完全沉淀时的c(OH-),根据c(Al3+)·c3(OH-)与Ksp[Al(OH)3]的比较,判断有无Al(OH)3沉淀。
计算;③指示剂的作用是指示出氯离子恰好沉淀完全,即让氯离子先沉淀,沉淀完全后,再滴入硝酸银溶液会生成一种颜色不同的沉淀来指示沉淀终点;(2)①根据Ksp[Al(OH)3]、Ksp[Cu(OH)2]分别计算开始生成氢氧化铝和氢氧化铜沉淀需要氢氧根离子的浓度,氢氧根离子浓度小的先沉淀;②计算Fe3+完全沉淀时的c(OH-),根据c(Al3+)·c3(OH-)与Ksp[Al(OH)3]的比较,判断有无Al(OH)3沉淀。
解析:(1) ①AgCl饱和溶液中c(Ag+)= ![]() 、AgBr饱和溶液中c(Ag+)=
、AgBr饱和溶液中c(Ag+)= ![]() 、AgI饱和溶液中c(Ag+)=
、AgI饱和溶液中c(Ag+)= ![]() 、Ag2S饱和溶液中c(Ag+)=
、Ag2S饱和溶液中c(Ag+)= ![]() 、Ag2CrO4饱和溶液中c(Ag+)=
、Ag2CrO4饱和溶液中c(Ag+)= ![]() , Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl>AgBr>AgI>Ag2S;②
, Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl>AgBr>AgI>Ag2S;②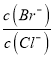 =
=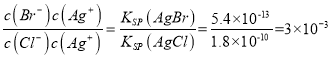 ;③氯化银、溴化银、碘化银的组成都是1:1,依据Ksp可以直接比较溶解性大小为氯化银>溴化银>碘化银;随Ksp的减小,应先出现碘化银沉淀、再出现溴化银,最后才沉淀氯化银;所以不符合滴定实验的目的和作用,不能测定氯化物的含量,故A不选; B、依据A分析可知碘化银优先于氯化银析出,不能测定氯化物的含量,故B不选; C、硫化银的Ksp很小,Ksp=[Ag+]2[S2-]=6.3×10-50,得到硫化银沉淀需要c(S2-)=
;③氯化银、溴化银、碘化银的组成都是1:1,依据Ksp可以直接比较溶解性大小为氯化银>溴化银>碘化银;随Ksp的减小,应先出现碘化银沉淀、再出现溴化银,最后才沉淀氯化银;所以不符合滴定实验的目的和作用,不能测定氯化物的含量,故A不选; B、依据A分析可知碘化银优先于氯化银析出,不能测定氯化物的含量,故B不选; C、硫化银的Ksp很小,Ksp=[Ag+]2[S2-]=6.3×10-50,得到硫化银沉淀需要c(S2-)=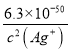 ,Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10,得到氯化银沉淀需要[Cl-]=
,Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10,得到氯化银沉淀需要[Cl-]=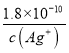 ,所以硫化银也比氯化银先沉淀.故C不选;铬酸银的阳、阴离子个数比为2:1,可以计算相同浓度的银离子沉淀氯离子、铬酸根离子需要的浓度,依据Ksp计算得到,Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10,Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=2.0×10-12;[Cl-]=
,所以硫化银也比氯化银先沉淀.故C不选;铬酸银的阳、阴离子个数比为2:1,可以计算相同浓度的银离子沉淀氯离子、铬酸根离子需要的浓度,依据Ksp计算得到,Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10,Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=2.0×10-12;[Cl-]=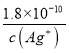 ;[CrO42-]=
;[CrO42-]=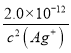 ;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4做指示剂可以正确的测定氯化物的含量,故D正确;(2)①Ksp[Al(OH)3]=1.1×10-33,0.1mol·L-1的AlCl3要生成氢氧化铝沉淀需要c(OH-)=
;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4做指示剂可以正确的测定氯化物的含量,故D正确;(2)①Ksp[Al(OH)3]=1.1×10-33,0.1mol·L-1的AlCl3要生成氢氧化铝沉淀需要c(OH-)= ![]() 、Ksp[Cu(OH)2]= 2.2×10-20,0.1mol·L-1的CuCl2要生成氢氧化铝沉淀需要c(OH-)=
、Ksp[Cu(OH)2]= 2.2×10-20,0.1mol·L-1的CuCl2要生成氢氧化铝沉淀需要c(OH-)=![]() ,氢氧根离子浓度小的先沉淀,所以Al(OH)3先沉淀;②Fe3+完全沉淀时的c3(OH-)=
,氢氧根离子浓度小的先沉淀,所以Al(OH)3先沉淀;②Fe3+完全沉淀时的c3(OH-)=![]() 4.0×10-33,此时c(Al3+)·c3(OH-)=8×10-34<Ksp[A1(OH)3],所以没有生成Al(OH)3沉淀。
4.0×10-33,此时c(Al3+)·c3(OH-)=8×10-34<Ksp[A1(OH)3],所以没有生成Al(OH)3沉淀。


科目:高中化学 来源: 题型:
【题目】某菱铁矿的主要成分是FeCO3,还含有SiO2、少量CaCO3和 Al2O3。下图是利用该菱铁矿制备磁性Fe3O4胶体粒子的简要工艺流程:

(1)菱铁矿石粉碎的目的是______________________________;碱浸可否用较便宜的Ca(OH)2替代NaOH?说明理由:______________________________________________。
(2) “不溶物”加稀盐酸可否改用不易挥发的稀硫酸?说明理由___________________________________________;“不溶物”加稀盐酸后“部分氧化”之前还有项操作,化学实验名称为__________。
(3) “部分氧化”离子方程式为________________________________________。
(4)如何实验验证“部分氧化”的滤液中存在Fe2+?__________________________________________________________________________________。
(5)Fe3O4胶粒的直径的范围是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:![]()
B. 若x<3,C的平衡浓度关系为:c(M)<c(N)
C. 若x>3,达到平衡后B的转化率关系为:![]()
D. x不论为何值,平衡时M、N中的平均相对分子质量都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定物质的所占有体积约为最大的是( )
A.标准状况下56 g 铁原子
B.标准状况下1mol C2H5OH
C.标准状况下6.02×1023 个NH3
D.通常状况下1molHCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的是( )
①![]() ②
②![]() ③
③![]() ④C2H4⑤CH2==CH—CH==CH2 ⑥C3H6 ⑦
④C2H4⑤CH2==CH—CH==CH2 ⑥C3H6 ⑦![]() ⑧
⑧![]()
A. ⑦⑧ B. ⑤⑦ C. ①②③ D. ④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. NH3易液化,可用作制冷剂
B. 浓H2SO4具有脱水性,可用来干燥HCl
C. FeCl3溶液呈酸性,可用于腐蚀电路板上的Cu
D. 碳酸钡不溶于水,可作钡餐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质。下列说法错误的是( )

A. 溶液中K+向电极b移动
B. 氨气在电极a上发生氧化反应
C. 反应消耗的NH3与O2的物质的量之比为4:3
D. 正极的电极反应式为:O2+4e-+2H2O=4OH-,故反应一段时间后,电解液的pH升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com