
【题目】19世纪中叶,门捷列夫总结了如表所示的元素化学性质的变化情况。请回答:
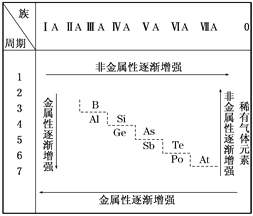
(1)门捷列夫的突出贡献是__________。
A.提出了原子学说
B.提出了分子学说
C.发现了元素周期律
D.发现能量守恒定律
(2)该表变化表明__________。
A.事物的性质总是在不断地发生变化
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.第ⅠA族元素的金属性肯定比同周期的第ⅡA族元素的金属性强
D.物质发生量变到一定程度必然引起质变
(3)按照表中元素的位置,认真观察从第ⅢA族的硼到第ⅦA族的砹连接的一条折线,我们能从分界线附近找到__________。
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
(4)据报道,美国科学家制得一种新原子![]() X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是__________。
X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是__________。
A.这种原子的中子数为167 B.它位于元素周期表中第6周期
C.这种元素一定是金属元素 D.这种元素的原子易与氢化合
【答案】 C CD C AC
【解析】(1)A.19世纪初,英国化学家道尔顿提出近代原子学说,A错误;B.19世纪初,意大利科学家阿伏加德罗提出分子概念,提出原子-分子学说,B错误;C.1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循,C正确;D.1756年俄国罗蒙诺索夫首先能量守恒定律,D错误;答案选C。(2)A.图示显示不同元素的递变规律,A错误;B.氦为稀有气体,性质最稳当,B错误;C.同周期,从左到右,金属性减弱,ⅠA族元素的失电子能力肯定比同周期ⅡA族元素的失电子能力强,C正确;D.同周期,随原子序数递增,元素从活泼金属→金属→两性元素→非金属→活泼非金属排列,物质发生量变到一定程度必然引起质变,D正确;答案选CD;(3)耐高温的合金材料在过渡元素区寻找;制农药的元素在周期表右上方的非金属元素区寻找;做催化剂的元素从过渡元素区寻找;作半导体材料的元素,在元素周期表金属元素与非金属元素的分界线附近寻找,而从ⅢA族的硼到ⅦA族的砹是元素周期表金属元素与非金属元素的分界线,所以作半导体材料的元素,答案选C;(4)稀有气体的原子序数分别为:2、10、18、36、54、86、118,116号元素与118号元素同周期,且位于118号元素的前2列,即116号元素处于第七周期ⅥA族,A.质量数为283,质子数为116,所以中子数为167,A正确;B.116号元素处于第七周期ⅥA族,B错误;C.该元素的金属性比Po强,一定为金属元素,C正确;D.该元素为金属元素,金属性比较弱,不易与氢化合,D错误,答案选AC。


科目:高中化学 来源: 题型:
【题目】香料G 的一种合成工艺如下图所示。

核磁共振氢谱显示A有两种峰,且峰面积之比为1:1。
已知:CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2

请回答下列问题:
(1)A的结构简式为_________,M中官能团的名称为________。
(2)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是:_______。
(3)写出下列转化的化学方程式,并标出反应类型:
D→E:______________,反应类型:________。
(4)F是M的同系物,比M多一个碳原子,F的同分异构体有多种,满足下列条件的F的同分异构体有_____种(不考虑立体异构),并写出核磁共振氢谱显示峰面积之比为1:2:2:2:3的结构简式__________。
① 能发生银镜反应 ② 能与溴的四氯化碳溶液加成 ③ 苯环上有2个对位取代基
(5)以丙烯和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选)。请用以下方式表示:![]() ______________
______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列关于氯水的叙述正确的是 ( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水不能使干燥的有色布条褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.新制氯水可使蓝色石蕊试纸先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属和卤素的说法中,错误的是( )。
A.随着核电荷数的增大,碱金属元素和卤素的原子半径都逐渐增大
B.碱金属元素中,锂原子失去电子的能力最弱,卤素中,氟原子得电子能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.溴单质与水反应比氯单质与水反应更剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g) + 3H2(g) ![]() 2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:
2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:
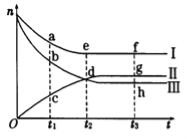
(1)上图中属于氢气物质的量随时间变化的曲线是 (填“I”、“II”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是
A.t2时该反应达到平衡状态
b.t2时II和III代表的物质反应速率相同
c.t2时氢气、氮气与氨气的反应速率之比为3:1:2
D.t2时氨气与氢气的物质的量相同
(3)对于II所代表的物质,其逆反应速率最大的点是__________(填“c”、“d”或“g”);对于I所代表的物质,其正反应速率最小的点是___________ (填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是____________(填序号)
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,—定条件下建立平衡:N2(g) + 3H2(g) ![]() 2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关第ⅦA族元素的单质和化合物性质说法正确的是( )
A.还原性:HF>HCl>HBr>HI
B.稳定性:HF<HCl<HBr<HI
C.从F2到I2 , 颜色逐渐加深
D.与氢气化合由易到难:I2>Br2>Cl2>F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐A是由三种元素组成的化合物,某研究小组按如图流程探究其组成:

请回答:
(1)写出红棕色固体C的化学式________________。
(2)写出A受热分解反应的化学方程式________________。
(3)写出检验A中阳离子的实验方案________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com