
【题目】用下列实验装置和方法进行相应实验,能达到实验目的的是
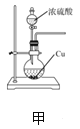



A. 用装置甲制备SO2
B. 用装置乙制备氨气
C. 用装置丙除去粗盐溶液中混有的沙子
D. 用装置丁蒸干溶液获得(NH4)2CO3晶体
科目:高中化学 来源: 题型:
【题目】下列关于SO2的说法中,不正确的是
A.SO2不能用来漂白食品
B.SO2具有漂白性,可以使品红溶液褪色
C.SO2与水反应生成H2SO4
D.SO2是一种大气污染物,它主要来自于化石燃料的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含锰矿石的主要成分是MnO2,还含CaO、Al2O3、FeS杂质,由此矿石生产MnCO3的工艺流程如图所示:


已知:①相关金属离子生成氢氧化物沉淀的pH如表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.8 | 4.7 |
Mn(OH)2 | 8.8 | 10.4 |
Ca(OH)2 | 12 | ─ |
②常温下,Ksp(CaF2)=3.95×10-11
回答下列问题:
(1)酸溶时,是否能将稀硫酸换成浓盐酸______(填“是”或“否”);操作I的名称为______________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中MnO2与FeS发生反应的离子方程式:______。
(3)调节溶液Ⅰ的pH时,pH的范围为_________;所用的物质X最好是________(填字母)。
A.盐酸 B.NaOH溶液 C.氨水 D.MnCO3固体
(4)滤渣Ⅰ为___________________,滤渣Ⅱ为_____________。(填化学式)
(5)沉锰的化学方程式为_________________________________________。
(6)沉锰后过滤得到固体MnCO3,设计实验方案验证MnCO3固体是否洗涤干净:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下列热化学反应方程式作出的判断正确的是
①CH4(g) + ![]() O2(g)= CO (g)+ 2H2O(g)
O2(g)= CO (g)+ 2H2O(g) ![]() H1 = a kJ·mol-1
H1 = a kJ·mol-1
②CH4 (g)+ 2O2(g)= CO2(g) + 2H2O(g) ![]() H2 = b kJ·mol-1
H2 = b kJ·mol-1
③C (s)+ ![]() O2 (g) = CO (g)
O2 (g) = CO (g) ![]() H3= c kJ·mol-1
H3= c kJ·mol-1
④H2 (g)+ ![]() O2 (g)=H2O (l)
O2 (g)=H2O (l) ![]() H4 =d kJ·mol-1
H4 =d kJ·mol-1
A. a>b
B. a + c<b
C. 2CO (g)+O2 (g) =2CO2 (g)的![]() H =(b-a)kJ·mol-1
H =(b-a)kJ·mol-1
D. CO (g) + H2O (g)=CO2 (g)+H2 (g)的![]() H =(b-a-d)kJ·mol-1
H =(b-a-d)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL溴乙烷,振荡。
实验操作Ⅱ:将试管如图固定后,水浴加热。

(1)用水浴加热而不直接用酒精灯加热的原因是_________;试管口安装一长导管的作用是________________________。
(2)观察到________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是_____________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是________________,检验的方法是______________________________说明所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯的同系物中,有的侧链能被KMnO4酸性溶液氧化,生成芳香酸,反应如下:
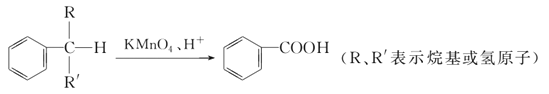
(1)现有苯的同系物甲、乙,分子式都是C10H14,甲不能被KMnO4酸性溶液氧化为芳香酸,它的结构简式是______________;乙能被KMnO4酸性溶液氧化为分子式为C8H6O4的芳香酸,则乙可能的结构有________种。
(2)有机物丙也是苯的同系物,分子式也是C10H14,它的苯环上的一溴代物只有一种,试写出丙所有可能的结构简式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四个起始容积相同的密闭容器中充入表中所示气体及相应的量,加入催化剂并控制温度、容积或压强,发生反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g) ![]() H<0,直至达平衡。下列说法错误的是
H<0,直至达平衡。下列说法错误的是
编号 | 条件 | 起始物质的量/mol | ||||
温度/℃ | 容积或压强 | CO(g) | NO (g) | CO2 (g) | N2 (g) | |
① | 600 | 维持恒容 | 0.2 | 0.2 | 0 | 0 |
② | 700 | 维持恒容 | 0.1 | 0.1 | 0.1 | 0.05 |
③ | 600 | 维持恒容 | 0.4 | 0.4 | 0 | 0 |
④ | 600 | 维持恒压 | 0.4 | 0.4 | 0 | 0 |
A. 平衡时N2的浓度:①>②
B. 平衡时CO的正反应速率:①<②
C. NO的平衡转化率:③>①
D. 平衡时容器内气体总压:④>③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在氢氧化钠溶液和硫酸铜溶液中片刻,如图,则下列说法正确的是( )

A. 两烧杯中均无气泡产生 B. 左边烧杯中的溶液质量减少了
C. 去掉两烧杯,杠杆仍平衡 D. 右边铁球上出现红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为迎接G20峰会的到来,浙江加大了对环境治理的力度。其中对含氮化物的处理是一个重要的课题。
Ⅰ.氮氧化物
(1)已知:N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况如下

①2NO(g) ![]() N2(g)+O2(g) △H=_______________
N2(g)+O2(g) △H=_______________
②你认为该反应能否自发,并说明理由____________________________________
(2)科学家利用2NO(g) ![]() N2(g)+O2(g)来消除NO的污染。1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol。在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,第25min时到达平衡;第30min时,保持温度和体积不变,向容器中再通入0.2molNO,第50min时达到平衡,请在右图中画出从第15min起到70minNO的物质的量随时间变化的曲线。_________
N2(g)+O2(g)来消除NO的污染。1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol。在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,第25min时到达平衡;第30min时,保持温度和体积不变,向容器中再通入0.2molNO,第50min时达到平衡,请在右图中画出从第15min起到70minNO的物质的量随时间变化的曲线。_________

Ⅱ.亚硝酸盐
(1)来源:用氧化性熔融盐处理钢铁表面氧化膜时会产生污染物亚硝酸盐,请写出FeO与NaNO3在加热条件下发生的反应________________________。
(2)电化学处理:用电解法降解NO2其原理如下图所示电源正极为_______(填A或B),阴极反应式为__________________________________ 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com