
【题目】工业合成氨的简易流程如下图所示:
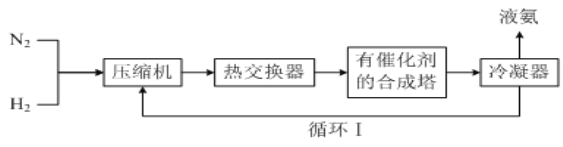
(1)通过循环Ⅰ可利用的气态物质是_______。
a.催化剂 b.只有N2 c.只有H2 d.N2和H2
(2)液氨常用作制冷剂,理由是___________________________________________________。
(3)互为同主族的N、P、As元素可以分别形成NH3 、PH3、AsH3,它们热稳定性的强弱关系为__________,运用相关理论解释结论:_____________________________________。
【答案】 d 液氨汽化时,会从环境中吸收大量热量而使环境温度下降 NH3>PH3>AsH3 随著N、P、K原子半径逐渐增大,N-H、P-H、As-H键长逐渐增长,热稳定性逐渐减弱
【解析】本题主要考查氨的性质。
(1)氨易冷凝为液氨而被分离,剩余N2和H2,故通过循环Ⅰ可利用的气态物质是d。
(2)液氨常用作制冷剂,理由是液氨汽化时,会从环境中吸收大量热量而使环境温度下降。
(3)互为同主族的N、P、As元素可以分别形成NH3 、PH3、AsH3,它们热稳定性的强弱关系为NH3>PH3>AsH3,运用相关理论解释结论:随著N、P、K原子半径逐渐增大,N-H、P-H、As-H键长逐渐增长,热稳定性逐渐减弱。


科目:高中化学 来源: 题型:
【题目】氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
A.加入浓氢氧化钠溶液都产生红褐色沉淀
B.能透过半透膜
C.分散质颗粒直径都在1~100 nm之间
D.颜色都呈红褐色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型可逆电池的工作原理如下图所示。放电时总反应为:Al+3Cn(AlCl4)+4AlCl4-![]() 4Al2Cl7-+3Cn(Cn表示石墨)。
4Al2Cl7-+3Cn(Cn表示石墨)。

下列说法正确的是
A. 放电时负极反应为:2Al-6e-+7Cl-= Al2Cl7-
B. 放电时AlCl4-移向正极
C. 充电时阳极反应为: AlCl4-e-+Cn=Cn(AlCl4)
D. 电路中每转移3mol电子,最多有1molCn(AlCl4)被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 甲烷分子的比例模型为![]() ,其二氯取代物有1种结构
,其二氯取代物有1种结构
B. 苯和乙烯都能使溴水褪色,其褪色原理相同
C. 相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同
D. 在一定条件下,苯与氯气生成氯苯的反应类型是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.过滤时用玻璃棒搅拌漏斗里的液体
B.加热后的蒸发皿用坩埚钳夹取
C.用自来水制蒸馏水实验中,将温度计水银球插到蒸烧瓶自来水中
D.从碘水中提取单质碘时,可用无水乙醇代替CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤干馏后可得到焦炭、煤焦油、粗氨水和焦炉气等。焦炭可通过以下途径制取聚氯乙烯等化工产品。

完成下列填空:
(1)上述乙炔转化为HC≡C-CH=CH2的反应类型是___________________。
(2)HC≡C-CH=CH2与正四面体烷![]() 的关系是______________________。
的关系是______________________。
(3)若分别完全燃烧等质量的HC≡C-CH=CH2和乙炔,所需氧气的量____________________ (选填“前者多”“后者多”“一样多”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列有关叙述正确的是( )
A. 室温下,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
B. 密闭容器中0.2molNO和0.1molO2充分反应后,分子总数为0.2NA
C. 7.8gNa2S和7.8gNa2O2中含有阴、阳离子总数均为0.3NA
D. 0.02molNa与0.1mol/L的盐酸充分反应,转移的电子数为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[Sr(NO3)2]可用于制作红色烟火、光学玻璃、电子管阴极材料等。由工业级硝酸锶(含有硝酸钡、硝酸钙等杂质)提取高纯硝酸锶的流程如下:

(1)滤液1中的主要溶质是___________(填化学式)。
(2)相对于水洗,滤渣1用浓硝酸洗涤的优点是________________________________。
(3)滤液2中过量的铬酸洗液被N2H4还原产生Cr3+和一种不污染环境的气体。该反应的离子方程式为______________________________________。
(4)滤渣3的主要成分是_____(填化学式);滤液3中c(Cr3+)=_____mol/L(常温下Ksp[Cr(OH)3]=6.3×10-31)。
(5)操作X为_____________;Sr(NO3)2·nH2O转化为高纯硝酸锶的过程温度要控制在100℃,目的是_________________。
(6)为测定Sr(NO3)2·nH2O的数值n,将7.44g Sr(NO3)2·nH2O晶体在100℃加热至恒重为6.36g的高纯硝酸锶。计算得n=______(M[Sr(NO3)2]=212g/mol)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com