
【题目】下列实验操作正确的是( )
A.过滤时用玻璃棒搅拌漏斗里的液体
B.加热后的蒸发皿用坩埚钳夹取
C.用自来水制蒸馏水实验中,将温度计水银球插到蒸烧瓶自来水中
D.从碘水中提取单质碘时,可用无水乙醇代替CCl4
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,其化学式都可表示为Z2X2Y![]() ,且C的摩尔质量比B大80g/
,且C的摩尔质量比B大80g/![]() ,请回答:
,请回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为_________(填字母代号)
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)下表为B与F实验的部分内容:
①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
②向20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀H2SO4反应的离子方程式______________________;
写出②中反应方程式___________________________。
(3)现由6种粒子![]() (C中含有的阴离子)、
(C中含有的阴离子)、![]() 完成一个离子方程式,已知
完成一个离子方程式,已知![]() 为还原剂,则得到
为还原剂,则得到![]() 需氧化剂的物质的量为_______
需氧化剂的物质的量为_______![]() .
.
(4)化合物D和E相互转化D![]() E,若有D和
E,若有D和![]() 的混合物13.04g,加热到完全反应后,气体产物通过浓
的混合物13.04g,加热到完全反应后,气体产物通过浓![]() 增重3.42g,剩余气体通过碱石灰增生2.20g,则
增重3.42g,剩余气体通过碱石灰增生2.20g,则![]() 的化学式为__________________________.
的化学式为__________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用只含有铜、铝、铁的工业废料来制备硫酸铜和硫酸铝晶体,实验流程如下:
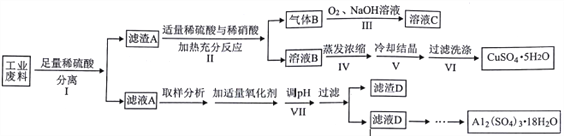
请回答:
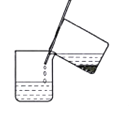
(1)步骤Ⅰ反应后分离操作可用下图所示方法,适用该方法分离的沉淀特点是___________________。
(2)写出步骤Ⅱ中发生反应的离子方程式___________________。写出步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式___________________。
(3)步骤Ⅳ蒸发浓缩的具体操作是___________________。
(4)下列有关实验说法正确的是___________________。
A. 步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可采用投入几粒晶种并加快溶液冷却速度的方法
B. 步骤Ⅵ过滤用如图装置,过滤结束时,为防止倒吸,可先关闭抽气泵,后打开活塞a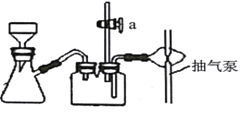
C. 步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D. 步骤Ⅶ调节pH时可加入氧化铝
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样a g溶于20 mL水中,加适量醋酸-醋酸铵缓冲溶液,再加入过量的c1 mol·L-1 EDTA溶液V1 mL,充分反应后稀释至250mL。
步骤二:取25.00mL上述稀释液,滴加指示剂,用c2 mol·L-1 ZnCl2溶液滴定过量的EDTA, 达到终点时消耗V2 mL ZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666g mol -1,EDTA分别能与Al3+ 或Zn2+ 以物质的量之比1:1进行反应。
根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为___________________(用含字母的代数式表示)。计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,小试管内为红墨水,U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不正确的是
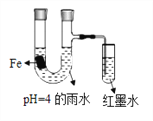
A. 生铁片中的铁是原电池的负极,发生氧化反应生成Fe2+
B. 开始时雨水酸性较强,生铁片发生析氢腐蚀
C. 墨水液面回升时,正极反应式为:O2+2H2O+4e-=4OH-
D. 如果将铁片换成铜片,也会出现开始小试管中的导管内的液面下降,一段时间后导管内的液面回升的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的简易流程如下图所示:
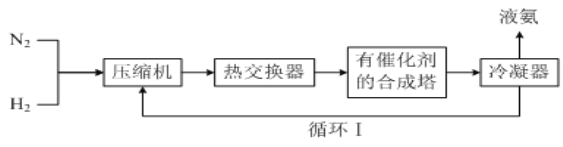
(1)通过循环Ⅰ可利用的气态物质是_______。
a.催化剂 b.只有N2 c.只有H2 d.N2和H2
(2)液氨常用作制冷剂,理由是___________________________________________________。
(3)互为同主族的N、P、As元素可以分别形成NH3 、PH3、AsH3,它们热稳定性的强弱关系为__________,运用相关理论解释结论:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积可变的密闭容器中,反应2SO2(g)十O2(g) ![]() 2SO3(g)在一定条件下达到平衡,完成下列填空:
2SO3(g)在一定条件下达到平衡,完成下列填空:
(1)工业上该反应是在________(填设备名称)进行的,所用的催化剂是________。
(2)其他条件不变时,降低温度,平衡向正反应方向移动,则正反应为_______(选填“吸热”“放热”)。下图为反应速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是__________(选填编号)。

a.增大O2的浓度
b. 扩大容器体积
c. 加入催化剂
d. 升高温度
(3)改变条件后,平衡混合物中SO3的百分含量_______(选填“增大”“减小”“不变”)。
(4)工业上用氨水来吸收SO2尾气,最终形成化肥(NH4)2 SO4,将(NH4)2 SO4固体溶于水,溶液呈_______性,理由是____________________(用离子方程式表示),该溶液体系中存在多种守恒,请任写出其中一种守恒关系(用离子浓度表示) _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】量取8.0 mL 5.0 mol·L-1 H2SO4溶液,加蒸馏水稀释至100 mL,取两份稀释后的H2SO4溶液各25 mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。请计算:

(1)稀释后H2SO4溶液的物质的量浓度为________mol·L-1。
(2)加入Fe的质量至少有____________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com