
【题目】某兴趣小组用只含有铜、铝、铁的工业废料来制备硫酸铜和硫酸铝晶体,实验流程如下:
请回答:
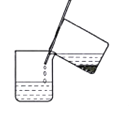
(1)步骤Ⅰ反应后分离操作可用下图所示方法,适用该方法分离的沉淀特点是___________________。
(2)写出步骤Ⅱ中发生反应的离子方程式___________________。写出步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式___________________。
(3)步骤Ⅳ蒸发浓缩的具体操作是___________________。
(4)下列有关实验说法正确的是___________________。
A. 步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可采用投入几粒晶种并加快溶液冷却速度的方法
B. 步骤Ⅵ过滤用如图装置,过滤结束时,为防止倒吸,可先关闭抽气泵,后打开活塞a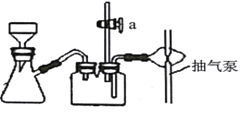
C. 步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D. 步骤Ⅶ调节pH时可加入氧化铝
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样a g溶于20 mL水中,加适量醋酸-醋酸铵缓冲溶液,再加入过量的c1 mol·L-1 EDTA溶液V1 mL,充分反应后稀释至250mL。
步骤二:取25.00mL上述稀释液,滴加指示剂,用c2 mol·L-1 ZnCl2溶液滴定过量的EDTA, 达到终点时消耗V2 mL ZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666g mol -1,EDTA分别能与Al3+ 或Zn2+ 以物质的量之比1:1进行反应。
根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为___________________(用含字母的代数式表示)。计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:___________________。
【答案】 沉淀颗粒较大,静置后容易沉降至容器底部 3Cu+8H+ +2NO3- =3Cu2+ +2NO↑+4H2O 4NO+3O2+4NaOH=4NaN03+2H2O 将溶液转移至蒸发皿中,小火加热至溶液表面出现晶膜,停止加热 D ![]() 所得晶体试样中可能含有Al2(SO4)3(或Al2(SO4)3·18H2O晶体失去部分结晶水或因水解产生碱式硫酸铝等
所得晶体试样中可能含有Al2(SO4)3(或Al2(SO4)3·18H2O晶体失去部分结晶水或因水解产生碱式硫酸铝等
【解析】只含有铜、铝、铁的工业废料加硫酸Al、Fe发生反应生成Al3+、Fe2+,过滤后滤渣A是铜,溶于硫酸和硝酸的混合物,生成溶液B硫酸铜,气体B为NO,与O2、NaOH反应4NO+3O2+4NaOH=4NaN03+2H2O生成溶液C,主要成分是NaN03;滤液A含Al3+、Fe2+,加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染,调溶液PH的目的是使Fe3+形成沉淀,滤渣D是Fe(OH)3.滤液D为Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体。(1)沉淀颗粒较大,静置后容易沉降至容器底部,可以用倾倒的方法分离。(2步骤Ⅱ中发生反应的离子方程式3Cu+8H+ +2NO3- =3Cu2+ +2NO↑+4H2O 。步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式4NO+3O2+4NaOH=4NaN03+2H2O。(3)步骤Ⅳ蒸发浓缩的具体操作是将溶液转移至蒸发皿中,小火加热至溶液表面出现晶膜,停止加热 。(4)A. 步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可采用投入1粒晶种并控制溶液冷却速度的方法,让晶体慢慢长大,故A错误;B. 步骤Ⅵ过滤用如图装置,过滤结束时,为防止倒吸,可先打开活塞a,后关闭抽气泵,故B错误;C. 步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,不能用玻璃棒搅拌,故C错误;D. 步骤Ⅶ调节pH时可加入氧化铝,与氢离子作用,促进铁离子的水解,故D正确;故选D。(5)ag中n(Al)=(![]() mmol,该试样中Al2(SO4)3·18H2O的纯度为M[Al2(SO4)3·18H2O]×n(Al)/2a×100%=666g mol -1×
mmol,该试样中Al2(SO4)3·18H2O的纯度为M[Al2(SO4)3·18H2O]×n(Al)/2a×100%=666g mol -1×![]() mmol/2a×100%=
mmol/2a×100%=![]() ;计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:所得晶体试样中可能含有Al2(SO4)3(或Al2(SO4)3·18H2O晶体失去部分结晶水或因水解产生碱式硫酸铝等。
;计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:所得晶体试样中可能含有Al2(SO4)3(或Al2(SO4)3·18H2O晶体失去部分结晶水或因水解产生碱式硫酸铝等。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在化学反应中发生物质变化的同时,不一定发生能量变化
B. ΔH>0表示放热反应,ΔH<0表示吸热反应
C. ΔH的大小与热化学方程式中化学计量数无关
D. 生成物释放的总能量大于反应物吸收的总能量时,ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究元素周期律,甲根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的研究;乙根据置换反应的规律,利用下图装置完成O元素的非金属性比S强的研究。回答:
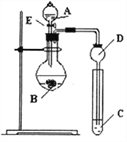
(1)图中A装置名称是______________。
(2)从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液 ②稀盐酸 ③碳酸钙 ④Na2SiO3 溶液 ⑤SiO2
试剂A与C分别为_________(填序号);试管中发生反应的离子方程式为_______________.有同学认为此实验不能说明N、C、S的非金属性强弱,你认为原因是_________________
(3)乙同学设计的实验所用到试剂A为________;如果C试剂为硫化氢的水溶液,则试管中可以观察到的现象为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A中碳的质量分数为92.3%,C与D互为同分异构体,F含有两个与乙醇相同的官能团,有关物质的转化关系如图:
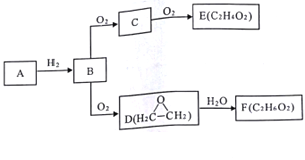
请回答:
(1)写出B的电子式___________________。
(2)C→E的反应类型___________________。
(3)D→F的化学方程式___________________。
(4)下列说法正确的是___________________。
A. 可用燃烧法鉴别A和B
B. C在一定条件下可与氢气发生还原反应
C. E和F在浓硫酸作用下加热反应,产物只有一种
D. 与D的最简式相同,相对分子质量为88的物质可能是E的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其相对分子质量为 136,分子式C8H8O2,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环,且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图。关于A的下列说法中不正确的是
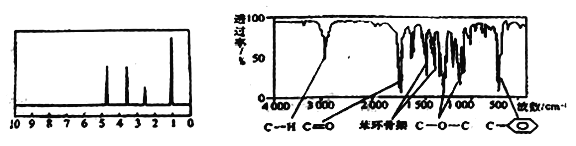
A. A分子属于酯类化合物,在一定条件下能发生水解反应
B. A在一定条件下可与3 mol H2发生加成反应
C. 符合题中A分子结构特征的有机物只有一种
D. 与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型可逆电池的工作原理如下图所示。放电时总反应为:Al+3Cn(AlCl4)+4AlCl4-![]() 4Al2Cl7-+3Cn(Cn表示石墨)。
4Al2Cl7-+3Cn(Cn表示石墨)。

下列说法正确的是
A. 放电时负极反应为:2Al-6e-+7Cl-= Al2Cl7-
B. 放电时AlCl4-移向正极
C. 充电时阳极反应为: AlCl4-e-+Cn=Cn(AlCl4)
D. 电路中每转移3mol电子,最多有1molCn(AlCl4)被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. HNO3的摩尔质量为63g
B. 常温、常压下,32克O2含有2NA个O
C. 标准状况下,1molH2O的体积约为22.4L
D. 1L1mol/LCH3COONa溶液中c(CH3COO—)=1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.过滤时用玻璃棒搅拌漏斗里的液体
B.加热后的蒸发皿用坩埚钳夹取
C.用自来水制蒸馏水实验中,将温度计水银球插到蒸烧瓶自来水中
D.从碘水中提取单质碘时,可用无水乙醇代替CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解精炼锡后的阳极泥中除含有一定量的Sn外,还含有Ag、Bi、Cu等金属,极具回收价值。某锡冶炼厂采用纯湿法工艺从阳极泥中提取Ag、Bi、Cu,流程如下:

已知:①BiCl3+H2O![]() BiOCl+2HCl
BiOCl+2HCl
②SnO2不溶于稀酸和碱溶液
(1)锡阳极泥在“氧化浸出”前需粉碎处理,目的是__________________________。
(2)“氧化浸出"时Cu发生反应的离子方程式为______________________。
(3)浸渣1的主要成分为AgCl和SnO2,则“氨浸出“时发生反应的化学方程式为______________。
(4)水合肼(N2H4·H2O)起_________作用(填“还原”或“氧化”)。已知N2H4为二元弱碱,在水中的电离与氨相似,其第一步电离的方程式为________________________。
(5)粗银电解冶炼时用_________作阳极,用_________溶液作电解液。
(6)“沉铜铋”时应将溶液的pH调至0.5~1.0之间,目的是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com