
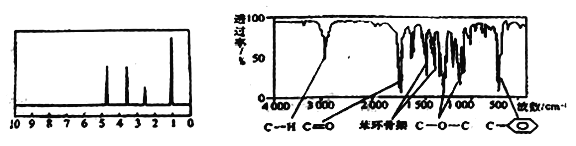
【题目】化合物A经李比希法和质谱法分析得知其相对分子质量为 136,分子式C8H8O2,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环,且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图。关于A的下列说法中不正确的是
A. A分子属于酯类化合物,在一定条件下能发生水解反应
B. A在一定条件下可与3 mol H2发生加成反应
C. 符合题中A分子结构特征的有机物只有一种
D. 与A属于同类化合物的同分异构体只有2种
【答案】D
【解析】A的分子式为C8H8O2,A的不饱和度为![]() =5,A的分子中只含一个苯环且苯环上只有一个取代基,苯环上有三种氢原子,且氢原子数为1、2、2,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,所以剩余的取代基上的3个H等效,为—CH3,结合红外光谱图知A中含酯基,A的结构简式为
=5,A的分子中只含一个苯环且苯环上只有一个取代基,苯环上有三种氢原子,且氢原子数为1、2、2,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,所以剩余的取代基上的3个H等效,为—CH3,结合红外光谱图知A中含酯基,A的结构简式为![]() 。A项,A分子中含酯基,属于酯类化合物,一定条件下能发生水解反应,正确;B项,A中的苯环能与H2发生加成反应,A在一定条件下可与3molH2发生加成反应,正确;C项,根据上述分析,符合条件的A的结构简式只有
。A项,A分子中含酯基,属于酯类化合物,一定条件下能发生水解反应,正确;B项,A中的苯环能与H2发生加成反应,A在一定条件下可与3molH2发生加成反应,正确;C项,根据上述分析,符合条件的A的结构简式只有![]() 一种,正确;D项,与A同类的同分异构体属于酯类,符合条件的同分异构体的结构简式为
一种,正确;D项,与A同类的同分异构体属于酯类,符合条件的同分异构体的结构简式为![]() 、
、![]() 、
、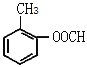 、
、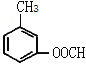 、
、![]() ,共5种,错误;答案选D。
,共5种,错误;答案选D。


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应表达正确的是( )
A. 1-丙醇与浓氢溴酸反应: CH3CH2 CH2OH + HBr ![]() CH3CH2 CH2Br + H2O
CH3CH2 CH2Br + H2O
B. 服用阿司匹林过量出现水杨酸(![]() )中毒反应, 可静脉注射 NaHCO3溶液:
)中毒反应, 可静脉注射 NaHCO3溶液:
![]() + 2 HCO3-→
+ 2 HCO3-→![]() + 2 CO2↑ + 2 H2O
+ 2 CO2↑ + 2 H2O
C. 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-![]() CH2BrCOO-+H2O
CH2BrCOO-+H2O
D. 向丙氨酸钠中加入足量盐酸: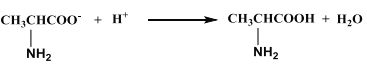
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以1,3-丁二烯,丙烯,乙炔等为原料合成![]() 流程图如下
流程图如下
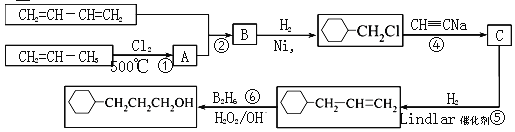
已知:有机反应中有一种双烯加成反应,如:CH2=CH—CH=CH2+CH2=CH2→ 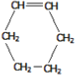 。
。
(1)反应①的反应类型是______________,B中含有的官能团的名称________________。
(2)写出反应②的化学方程式__________________________。
(3)写出C的结构简式_______________。
(4)写出![]() 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式__________。
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式__________。
(5)根据以上合成信息,以乙烯为原料合成1,6—己二醇,其他试剂任选,写出合成的流程图________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知固体A受热易分解,实验流程和结果如下:

B和C为常见气体且所含元素相同。气体C在标准状况下密度为1.96g·L-1。请回答:
(1)白色沉淀的化学式___________________。
(2)写出A受热分解的化学方程式___________________。
(3)取少量固体D溶于稀硫酸,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀。写出产生该现象的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用只含有铜、铝、铁的工业废料来制备硫酸铜和硫酸铝晶体,实验流程如下:
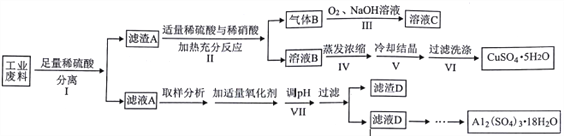
请回答:
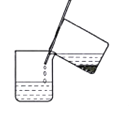
(1)步骤Ⅰ反应后分离操作可用下图所示方法,适用该方法分离的沉淀特点是___________________。
(2)写出步骤Ⅱ中发生反应的离子方程式___________________。写出步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式___________________。
(3)步骤Ⅳ蒸发浓缩的具体操作是___________________。
(4)下列有关实验说法正确的是___________________。
A. 步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可采用投入几粒晶种并加快溶液冷却速度的方法
B. 步骤Ⅵ过滤用如图装置,过滤结束时,为防止倒吸,可先关闭抽气泵,后打开活塞a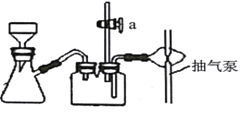
C. 步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D. 步骤Ⅶ调节pH时可加入氧化铝
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样a g溶于20 mL水中,加适量醋酸-醋酸铵缓冲溶液,再加入过量的c1 mol·L-1 EDTA溶液V1 mL,充分反应后稀释至250mL。
步骤二:取25.00mL上述稀释液,滴加指示剂,用c2 mol·L-1 ZnCl2溶液滴定过量的EDTA, 达到终点时消耗V2 mL ZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666g mol -1,EDTA分别能与Al3+ 或Zn2+ 以物质的量之比1:1进行反应。
根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为___________________(用含字母的代数式表示)。计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
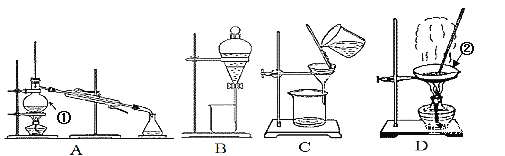
(1)装置A中仪器①的名称是______。
(2)从氯化钾溶液中得到氯化钾固体,应选择装置_____(填代表装置图的字母,下同)。
(3)分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)(已知四氯化碳和甲苯互溶),应选择装置______。
(4)从碘水中分离出I2,该装置的主要仪器名称是______,若用CCl4作为萃取剂,充分振荡后静置,观察到的现象是:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能发生的反应中,离子方程式正确的是
A. 硫酸与Ba(OH)2溶液混合:Ba2++OH-+H++SO![]() ===H2O+BaSO4↓
===H2O+BaSO4↓
B. 足量的氯气通入FeBr2溶液中:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
C. 碳酸钙和盐酸混合:CO![]() +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
D. MgCl2溶液中通入二氧化碳:Mg2++CO2+H2O===MgCO3↓+2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com