
【题目】海洋是资源的宝库,醢藏着丰富的化学元素,如氯、溴、碘等,海洋资源的综合利用具有非常广阔的前景。
(1)下列说法正确的是_________。
a.AgCl、AgBr、AgI的颜色依次变深 b.F、Cl、Br、I的非金属性依次增强
c.HF、HCl、HBr、HI的还原性的依次增强 d.F2、Cl2、Br2、I2与H2化合由难变易
(2)实验室从海藻灰中提取少量碘的流程如下图:
![]()
①氧化时,可以加入MnO2在酸性条件下进行氧化,反应的离子方程式为:_________。
②上述步骤①②③分离操作分别为过滤、_________、_________。
(3)从海水提取的粗盐中含有Mg2+、Fe2+、Ca2+和SO42—等杂质,“除杂”所需试剂有:①过量的NaOH溶液②过量的Na2CO3溶液③适量的盐酸④过量的BaCl2溶液.试剂的添加顺序为_________。
为使Ca2+完全沉淀,溶液中c(CO32—)应不小于_________mol/L。[已知Ksp(CaCO3)=2.9×10-9,离子浓度小于1×10-5mol/L视为完全沉淀]
(4)目前,利用食盐制取纯碱主要有“氨碱法”和“联合制碱法”两种工艺
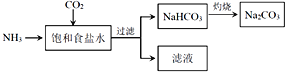
①能析出 NaHCO3的原因是_________。
②“氨碱法”是在滤液中加入_________产生NH3,循环使用,但产生大量的度弃物CaCl2;“联合制碱法“是在滤液中继续通入NH3,并加入NaCl粉末以制得更多的副产物_________。
③常温下,向饱和食盐水中通入NH3和CO2,当(HCO3—)=c(NH4+)时,溶液的pH_____7 (填“>”、“<”或“=”)。
【答案】ac MnO2+2I—+4H+=Mn2++I2+2H2O 分液 蒸馏 ①④②③(或④②①③或④①②③) 2.9×10-44) NaHCO3的溶解度最小 CaO[或Ca(OH)2] NH4Cl 小于
【解析】
(1) a.AgCl、AgBr、AgI的颜色分别为白色、浅黄色、黄色,依次变深;
b.F、Cl、Br、I的非金属性依次减弱,金属性依次增强;
c.HF、HCl、HBr、HI的稳定性依次减弱,即还原性的依次增强;
d.F2、Cl2、Br2、I2与H2化合由易变难;
(2)①氧化时,在酸性条件下MnO2与碘离子反应生成二价锰离子、碘单质和水;
②步骤①为固液分离,方法为过滤;②为萃取后分液;③蒸发掉有机物生成晶态碘;
(3) 除Mg2+、Fe2+用NaOH,除Ca2+用碳酸钠,除SO42-用氯化钡溶液,但会引入钡离子,除钡离子也用碳酸钠,则除硫酸根离子在除钙离子之前,过滤后再加盐酸除去碳酸根离子和氢氧根离子;根据Ksp(CaCO3)计算;
(4) ①NaHCO3的溶解度小于碳酸钠的;
②“氨碱法”滤液中的主要成分为氯化铵;
③根据溶液呈电中性计算、判断。
(1) a.AgCl、AgBr、AgI的颜色分别为白色、浅黄色、黄色,依次变深,a正确;
b.F、Cl、Br、I的非金属性依次减弱,金属性依次增强,b错误;
c.HF、HCl、HBr、HI的稳定性依次减弱,即还原性的依次增强,c正确;
d.F2、Cl2、Br2、I2与H2化合由易变难,d错误;
答案为ac;
(2)①氧化时,在酸性条件下MnO2与碘离子反应生成二价锰离子、碘单质和水,离子方程式为MnO2+2I-+4H+=Mn2++I2+2H2O;
②步骤①为固液分离,方法为过滤;②为萃取后分液;③蒸发掉有机物生成晶态碘;
(3) 除Mg2+、Fe2+用NaOH,除Ca2+用碳酸钠,除SO42-用氯化钡溶液,但会引入钡离子,除钡离子也用碳酸钠,则除硫酸根离子在除钙离子之前,过滤后再加盐酸除去碳酸根离子和氢氧根离子,添加顺序为①④②③(或④②①③或④①②③);Ksp(CaCO3)=c(Ca2+)×c(CO32-)=2.9×10-9,则c(CO32-)=2.9×10-4mol/L;
(4) ①NaHCO3的溶解度小于碳酸钠的,则饱和碳酸钠溶液中通二氧化碳和氨气时能析出碳酸氢钠;
②“氨碱法”滤液中的主要成分为氯化铵,加入CaO[或Ca(OH)2]时可产生氨气;在滤液中继续通入NH3,并加入NaCl粉末能得到更多的氯化铵;
③根据溶液呈电中性,c(Na+)+c(H+)+c(NH4+)=c(Cl-)+c(OH-)+c(HCO3-)+2c(CO32-),c(Na+)=c(Cl-),c(NH4+)=c(HCO3-),则c(H+)= c(OH-)+2c(CO32-),溶液呈酸性,pH<7。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示:
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
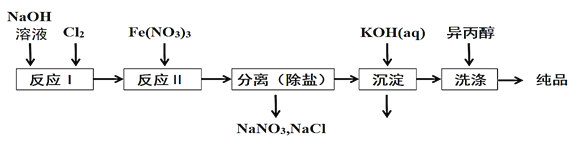
①洗涤粗品时选用异丙醇而不用水的理由是:________。
②反应II的离子方程式为___________。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为_______它能净水的原因是_______。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是:__________。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠____(填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂和还原剂的物质的量之比________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲是当代高科技材料不可缺少的重要组成元素。以铋碲矿(主要含Te、Bi、Si、S等元素)为原料生产精碲的工艺流程如下:
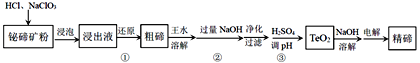
已知:TeO2是两性氧化物,微溶于水.回答下列问题:
(1)浸出液中碲以TeO2+存在,步骤①加入Na2SO3进行还原,反应的离子方程式为________。Na2SO3的实际用量比理论用量偏多,其主要原因是________。
(2)王水是由约3体积浓盐酸和约1体积浓硝酸配制而成。在实验室中配制王水所用的玻璃仪器除玻璃棒外还有________。王水溶解粗碲时,加入的碲粉与生成的NO的物质的量之比为________。
(3)粗碲中仍含有硅元素,净化时加入CaCl2溶液可以除去硅元素,硅元素将以________(填化学式)形式被除去。
(4)步骤③,将Na2TeO3转化为TeO2,反应的离子方程式是________。
(5)电解时,精碲在______极析出,电解产物中可循环使用的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:X2(g)+3Y2(g) ![]() 2Z2(g),若X2、Y2、Z2的初始物质的量浓度分别为0.10mol·L-1、0.30mol·L-1、0.20mol·L-1,当反应达到平衡时Z2的物质的量浓度不可能是
2Z2(g),若X2、Y2、Z2的初始物质的量浓度分别为0.10mol·L-1、0.30mol·L-1、0.20mol·L-1,当反应达到平衡时Z2的物质的量浓度不可能是
A. 0.05mol·L-1 B. 0.20mol·L-1 C. 0.35mol·L-1 D. 0.40mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJ mol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJ mol-1。
请回答下列问题:
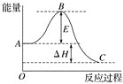
(1) 图中ΔH=___kJ mol-1。
(2) 如果反应速率υ(SO2)为0.05 molL-1min-1,则υ(O2)=___ molL-1min-1、υ(SO3)=____ molL-1min-1;
(3) 已知单质硫的燃烧热为296 kJ mol-1,计算由S(s)生成3 mol SO3(g)的ΔH=___kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,反应:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
A.气体的压强不变B.气体平均相对分子质量不变
C.气体的密度不变D.B物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应![]() 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
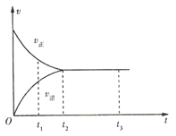
A.t1时,反应只向正方向进行B.t2时,反应未达到限度
C.t2~t3,反应已停止D.t2~t3,各物质的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉花香气成分有多种,乙酸苯甲酯(![]() )是其中一种,它可以从茉莉花中提取,也可用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中一种,它可以从茉莉花中提取,也可用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
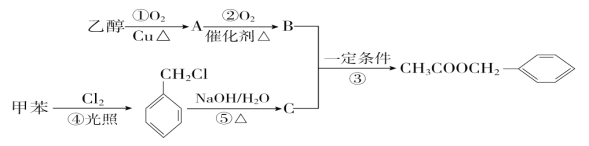
(1)B的结构简式分别为___;反应⑤的反应类型分别为___。
(2)写出反应①、③的化学方程式:
①____;
③____。
(3)反应___(填序号)原子的理论利用率为100%,符合“绿色化学”的要求。
(4)符合下列条件的乙酸苯乙酯的同分异构体的数目有___个
I、能发生银镜反应 II、能发生水解反且水解产物能与FeCl3溶液发生显色反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com