
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示:
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
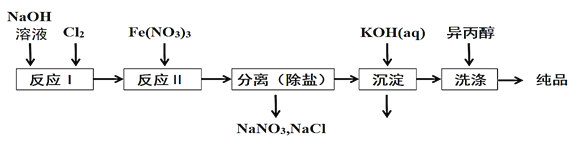
①洗涤粗品时选用异丙醇而不用水的理由是:________。
②反应II的离子方程式为___________。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为_______它能净水的原因是_______。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是:__________。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠____(填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂和还原剂的物质的量之比________
【答案】减少高铁酸钾的溶解损失 3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O 高铁酸钾具有强氧化性 高铁酸钾的还原产物水解生成氢氧化铁胶体,具有吸附性,可以净水 增大K+浓度,促进K2FeO4晶体析出 小 3:1
【解析】
(1)①洗涤粗品时用水主要是减少高铁酸钾的溶解损失。②反应II是在强碱性介质中,Fe(NO3)3与NaClO反应生成氯离子、高铁酸根。③高铁酸钾在水中能消毒杀菌是因为高铁酸钾中铁处于+6价,化合价易降低,高铁酸钾的还原产物铁离子水解生成氢氧化铁胶体。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是:从平衡移动原理理解,增大K+浓度,促进K2FeO4晶体析出,故答案为:增大K+浓度,促进K2FeO4晶体析出。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠小,故答案为:小。
(3)干法制备K2FeO4的反应是Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物,氧化铁中铁化合价升高6个,硝酸钾中氮化合价降低2个,根据升降守恒得到n(Fe2O3):n(KNO3) =1:3,因此反应中氧化剂和还原剂的物质的量之比3:1,故答案为:3:1。
(1)①洗涤粗品时选用异丙醇而不用水的理由是减少高铁酸钾的溶解损失,故答案为:减少高铁酸钾的溶解损失。
②反应II是在强碱性介质中,Fe(NO3)3与NaClO反应生成氯离子、高铁酸根,其离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,故答案为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O。
③高铁酸钾在水中能消毒杀菌是因为高铁酸钾中铁处于+6价,化合价易降低,因此具有强氧化性,它能净水的原因是高铁酸钾的还原产物铁离子水解生成氢氧化铁胶体,具有吸附性,可以净水,故答案为:高铁酸钾具有强氧化性;高铁酸钾的还原产物水解生成氢氧化铁胶体,具有吸附性,可以净水。
(2)①向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,利用平衡移动原理分析。
②由以上信息得出高铁酸钾的溶解度与高铁酸钠关系。
(3)干法制备K2FeO4的反应是Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物,利用化合价升降分析。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知△H1=-99kJ·mol-1 ,△H3=+41kJ·mol-1,则△H2=_________kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为____________;图1中能正确反映平衡常数K随温度变化关系的曲线为_______(填曲线标记字母),其判断理由是________。
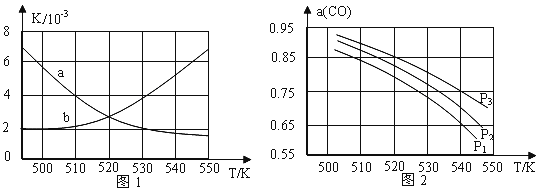
(3)若开始各气体的物质的量一定时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。则α(CO)值随温度升高而_____(填“增大”或“减小”);图2中的压强由大到小为_____________,其判断理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是
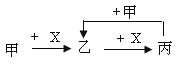
A.C和O2B.SO2 和NaOH溶液
C.Cl2和FeD.AlCl3溶液和NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成高分子金属离子螯合剂的反应:
 +(2n-1)H2O
+(2n-1)H2O
下列说法不正确的是
A.聚合物应避免与碱性物质(如NaOH)长期接触
B.聚合物的合成反应为缩聚反应
C.1mol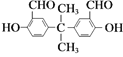 与足量银氨溶液作用可析出2mol银
与足量银氨溶液作用可析出2mol银
D.通过质谱法测定其平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中发生反应:![]() ,正反应为吸热反应,H2O和H2的物质的量随时间的变化如图所示,2min时仅改变一个条件,则改变的条件是( )
,正反应为吸热反应,H2O和H2的物质的量随时间的变化如图所示,2min时仅改变一个条件,则改变的条件是( )
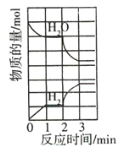
A.减小n(H2O)B.增大n(H2)
C.增大压强(减小容器体积)D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 A 的结构简式是![]() ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
B. C.
C.![]() D.
D.![]()
(1)A 中官能团的名称是______________。
(2)写出由 A 制取 C 的有机反应类型:_____________。
(3)写出由 A 制取 B 的化学方程式:_______________________________________。
(4)写出D与足量的NaOH溶液共热时反应的化学方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对溴苯乙烯与丙烯的共聚物E是一种高分子阻燃剂,具有低毒、热稳定性好等优点.由烃A合成E的路线如图所示.
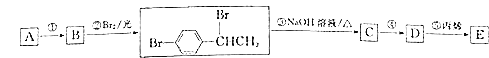
回答下列问题:
(1)![]() 的名称 ______ ;
的名称 ______ ;![]() 的反应条件 ______ .
的反应条件 ______ .
(2)共聚物E的结构简式 ______ .
(3)反应![]() 的化学方程式 ______
的化学方程式 ______ ![]() 反应
反应![]() 的化学方程式 ______ .
的化学方程式 ______ .
(4)满足下列条件的C的同分异构体的结构简式 ______ ![]() 任写一种
任写一种![]() .
.
![]() 能使
能使![]() 溶液呈紫色
溶液呈紫色 ![]() 核磁共振氢谱显示有3组峰面积比为6:2:1.
核磁共振氢谱显示有3组峰面积比为6:2:1.
(5)丙烯催化二聚得到2,![]() 二甲基
二甲基![]() 丁烯,F与2,
丁烯,F与2,![]() 二甲基
二甲基![]() 丁烯互为同分异构体,且所有碳原子处于同一平面,写出F的结构简式 ______ .
丁烯互为同分异构体,且所有碳原子处于同一平面,写出F的结构简式 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,醢藏着丰富的化学元素,如氯、溴、碘等,海洋资源的综合利用具有非常广阔的前景。
(1)下列说法正确的是_________。
a.AgCl、AgBr、AgI的颜色依次变深 b.F、Cl、Br、I的非金属性依次增强
c.HF、HCl、HBr、HI的还原性的依次增强 d.F2、Cl2、Br2、I2与H2化合由难变易
(2)实验室从海藻灰中提取少量碘的流程如下图:
![]()
①氧化时,可以加入MnO2在酸性条件下进行氧化,反应的离子方程式为:_________。
②上述步骤①②③分离操作分别为过滤、_________、_________。
(3)从海水提取的粗盐中含有Mg2+、Fe2+、Ca2+和SO42—等杂质,“除杂”所需试剂有:①过量的NaOH溶液②过量的Na2CO3溶液③适量的盐酸④过量的BaCl2溶液.试剂的添加顺序为_________。
为使Ca2+完全沉淀,溶液中c(CO32—)应不小于_________mol/L。[已知Ksp(CaCO3)=2.9×10-9,离子浓度小于1×10-5mol/L视为完全沉淀]
(4)目前,利用食盐制取纯碱主要有“氨碱法”和“联合制碱法”两种工艺
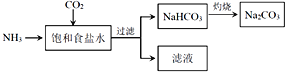
①能析出 NaHCO3的原因是_________。
②“氨碱法”是在滤液中加入_________产生NH3,循环使用,但产生大量的度弃物CaCl2;“联合制碱法“是在滤液中继续通入NH3,并加入NaCl粉末以制得更多的副产物_________。
③常温下,向饱和食盐水中通入NH3和CO2,当(HCO3—)=c(NH4+)时,溶液的pH_____7 (填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com