
【题目】在恒容密闭容器中发生反应:![]() ,正反应为吸热反应,H2O和H2的物质的量随时间的变化如图所示,2min时仅改变一个条件,则改变的条件是( )
,正反应为吸热反应,H2O和H2的物质的量随时间的变化如图所示,2min时仅改变一个条件,则改变的条件是( )
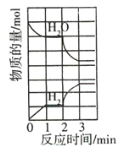
A.减小n(H2O)B.增大n(H2)
C.增大压强(减小容器体积)D.升高温度
【答案】D
【解析】
由图可知0-1min时,H2O的物质的量减小,H2的物质的量增加,说明平衡正向移动;1-2min,H2O和H2的物质的量不再改变,说明反应达到平衡状态;2min时仅改变一个条件,使H2O的物质的量减小,H2的物质的量增加,说明平衡正向移动。
A.恒容密闭容器中,减小n(H2O),平衡逆向移动,氢气的物质的量应该减小,与图象不符,A错误;
B.恒容密闭容器中,增大n(H2),平衡逆向移动,n(H2O)应增大,与图象不符,B错误;
C.该反应是反应前后气体体积不变的反应,增大压强(减小容器体积),平衡不移动,气体的物质的量不变,与图象不符,C错误;
D.正反应吸热,升高温度,平衡正向移动,与图象相符,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】在一个容积为500mL的密闭容器中,充入5mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应在:2H2(g) +CO(g)![]() CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的
CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的![]() ,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,采用以下路线合成X。
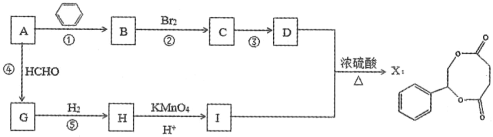
已知:RC≡CH+HCHO![]() RC≡CCH2OH
RC≡CCH2OH
请回答下列问题:
(1)若反应①、②、④的原子利用率均为100%,则A的名称为:________。
(2)物质G的结构简式为:_________。
(3)写出反应③的化学反应方程式:_________。
(4)物质E是D催化氧化后生成的有机产物,E能发生银镜反应,写出E中官能团名称:________。
(5)物质H和物质I可以在一定条件下合成链状聚合物,请写出化学方程式:______。
(6)符合下列条件的D的同分异构体共有_______种,写出其中一种的结构简式_____。
i.与FeCl3溶液能发生显色反应 ii.苯环上的一氯代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
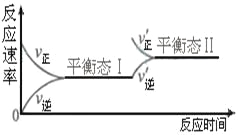
A. 反应达平衡时,正反应速率和逆反应速率相等
B. 该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C. 该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D. 同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示:
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
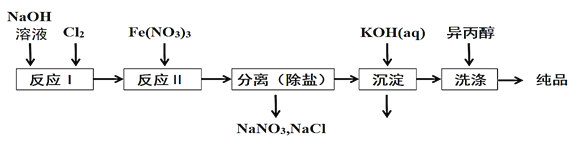
①洗涤粗品时选用异丙醇而不用水的理由是:________。
②反应II的离子方程式为___________。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为_______它能净水的原因是_______。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是:__________。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠____(填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂和还原剂的物质的量之比________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说祛正确的是
A. 蛋白质是仅由碳、氢、氧、氯元素组成的一类高分子化合物
B. 可以用溴水鉴别![]() 和
和![]()
C. 用甲苯分别制取TNT、邻溴甲苯和苯甲酸所涉及的反应均为取代反应
D. ![]() 的一氯代物共有5种(不考虑立体异构)
的一氯代物共有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C是中学化学中最常见的三种有机物,D是高分子化合物,常用来制造食品和药品包装袋,已知这四种物质之间存在如图所示关系:
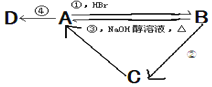
(1)写出反应类型:①___,③____,④____。
(2)反应②的条件是____。
(3)写出化学方程式:B→C:___,A→D:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及铁的化合物在生活、生产中具有广泛应用,如亚铁氰化钾即K4[Fe(CN)6]是食盐中常用的抗结剂、铁基(氟掺杂镨氧铁砷化合物)是高温超导材料、“愚人金”是制备硫酸的主要矿物原料。请按要求回答下列问题。
(1)K4[Fe(CN)6]配合物中存在的作用力类型有__________________________(从“金属键”、“离子键”、“共价键”、“配位键”、“氢键”、“范德华力”中选填);其中CN-中各原子最外层均满足8电子稳定结构,其电子式为_____________,其中C原子的杂化形式是_________。
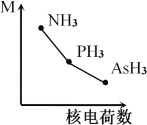
(2)铁基化合物中氟、氧、砷三种元素中电负性值由大到小的顺序是_____________(填元素符号)。其中氢化物(RH3)的某种性能(M)随R的核电荷数的变化趋势如图所示,则纵轴M可能表示为_____________________(从“沸点”、“稳定性”、“分子间作用力”、“R—H键能”中选填)。
(3)FeCl3晶体熔点为306℃,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:____________________________________________。
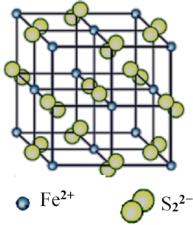
(4)“愚人金”是铁硫化合物,其晶体的晶胞如图所示。该晶体的化学式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,反应:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
A.气体的压强不变B.气体平均相对分子质量不变
C.气体的密度不变D.B物质的量浓度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com