
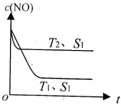
 (1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.
(1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.| 1.0mol/L |
| 5min |
| c2(NO) |
| c(N2)?c(O2) |
| 1.02 |
| 0.8×1.0 |
| 2.02 |
| 1.8×1.2 |
| m |
| V |
| m |
| n |

 .
.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-128.1 kJ?mol-1 |
| B、-411.1 kJ?mol-1 |
| C、-157.7 kJ?mol-1 |
| D、+157.7 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①将含铜废料研成粉末 | - | ②加过量热碱溶液,过滤 | - | ③滤渣用水洗至pH=7 | - | ④加稍过量稀硫酸,加热条件下通空气搅拌至固体基本溶解 |
| ⑧分离得到胆矾晶体 | ← | ←⑦再将滤液用硫酸调节pH=2~3 | ⑥调节pH=5.2沉降1小时之后过滤 | ← | ⑤再加H2O2于80℃保温半小时 |
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据正放在桌面上的如图装置,回答下列问题:
根据正放在桌面上的如图装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸,产生使澄清石灰水变浑浊的无色气体 | 该溶液中一定含CO32- |
| B | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| C | SO2可使酸性KMnO4溶液褪色 | SO2具有漂白性 |
| D | 某溶液中加入NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝色的气体 | 该溶液中含有NH4+离子 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
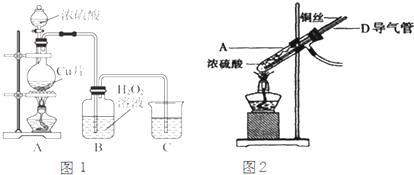
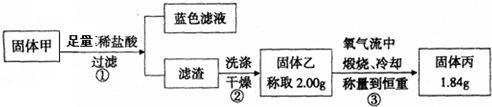
查看答案和解析>>
科目:高中化学 来源: 题型:
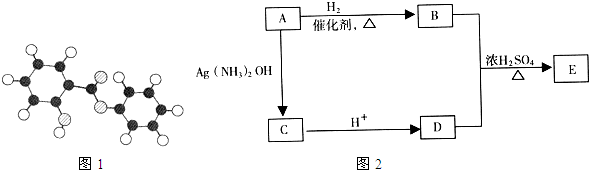
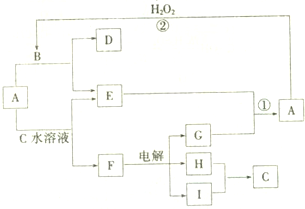 A-I均为中学化学常见的物质,其转化关系如图所示(部分产物已略去).已知:A为酸式盐,且A是焰色反应为紫色(透过蓝色钴玻璃);B与A的组成元素完全相同;C、E、H、I为气体,且H、I为单质.
A-I均为中学化学常见的物质,其转化关系如图所示(部分产物已略去).已知:A为酸式盐,且A是焰色反应为紫色(透过蓝色钴玻璃);B与A的组成元素完全相同;C、E、H、I为气体,且H、I为单质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com