
【题目】咖啡酸乙酯具有抗炎作用且有治疗自身免疫性疾病的潜力,其合成路线如图所示:

(1)用系统命名法命名A的名称是__________,E中含氧官能团的名称是____________。
(2)反应② 的条件是_______________________,反应⑦中所属反应类型是___________。
(3)写出下列反应的化学方程式:反应①________________;反应⑦_________________。
(4)芳香族化合物M是H的同分异构体,1 mol M与足量碳酸氢钠溶液反应生成2 molCO2 ,M的同分异构体有_____种;其中核磁共振氢谱为5组峰,峰面积比为1∶2∶2∶2∶1的结构简式为_____________(任写一种)。
(5)写出以甲醇和丙二酸为原料,合成丙烯酸(CH2=CH—COOH)的合成路线(其它试剂任选)_______________________________。
【答案】1,3-二氯丙烷 醛基 Cu, O2 / 取代反应(或酯化反应) ![]()
![]() 10
10 ![]()
![]()
【解析】
(1)A为![]() ,属于卤代烃,最长碳链3个碳,氯原子在1,3位,用系统命名法命名A的名称是1,3-二氯丙烷,E为
,属于卤代烃,最长碳链3个碳,氯原子在1,3位,用系统命名法命名A的名称是1,3-二氯丙烷,E为![]() ,含氧官能团的名称是醛基;
,含氧官能团的名称是醛基;
(2)根据转化关系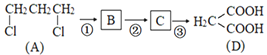 可知,A在氢氧化钠的水溶液中水解生成1,3-丙二醇,1,3-丙二醇发生氧化反应生成1,3-丙二醛,1,3-丙二醛发生氧化反应生成D为1,3-丙二酸,故反应② 的条件是Cu, O2 / ;
可知,A在氢氧化钠的水溶液中水解生成1,3-丙二醇,1,3-丙二醇发生氧化反应生成1,3-丙二醛,1,3-丙二醛发生氧化反应生成D为1,3-丙二酸,故反应② 的条件是Cu, O2 / ;
根据转化![]() ,结合H和咖啡酸乙酯的结构简式可知,H与乙醇发生酯化反应生成咖啡酸乙酯,故反应类型为取代反应或酯化反应;
,结合H和咖啡酸乙酯的结构简式可知,H与乙醇发生酯化反应生成咖啡酸乙酯,故反应类型为取代反应或酯化反应;
(3)反应①是![]() 在氢氧化钠的水溶液中加热发生水解反应生成HOCH2CH2CH2OH和氯化钠,反应的化学方程式为
在氢氧化钠的水溶液中加热发生水解反应生成HOCH2CH2CH2OH和氯化钠,反应的化学方程式为![]() ;反应⑦是
;反应⑦是![]() 与乙醇在浓硫酸催化下发生酯化反应生成
与乙醇在浓硫酸催化下发生酯化反应生成![]() 和水,反应的化学方程式为
和水,反应的化学方程式为![]() ;
;
(4)H为![]() ,芳香族化合物M是H的同分异构体,1 mol M与足量碳酸氢钠溶液反应生成2 molCO2 ,则M分子中含有两个羧基,不含碳碳双键,若苯环上只有一个取代基则为-CH(COOH)2,只有一种结构;若含有两个取代基,则为-CH2COOH和-COOH,两取代基在苯环上有邻、间、对位三种结构;若有三个取代基,则为两个羧基和一个甲基,两个羧基在苯环上有邻、间、对位,苯环上再取代甲基分别有2种、3种和1种其6种结构;故符合条件的M的同分异构体总共有10种;其中核磁共振氢谱为5组峰,峰面积比为1∶2∶2∶2∶1的结构简式为
,芳香族化合物M是H的同分异构体,1 mol M与足量碳酸氢钠溶液反应生成2 molCO2 ,则M分子中含有两个羧基,不含碳碳双键,若苯环上只有一个取代基则为-CH(COOH)2,只有一种结构;若含有两个取代基,则为-CH2COOH和-COOH,两取代基在苯环上有邻、间、对位三种结构;若有三个取代基,则为两个羧基和一个甲基,两个羧基在苯环上有邻、间、对位,苯环上再取代甲基分别有2种、3种和1种其6种结构;故符合条件的M的同分异构体总共有10种;其中核磁共振氢谱为5组峰,峰面积比为1∶2∶2∶2∶1的结构简式为![]() ;
;
(5)甲醇在铜的催化下发生氧化反应生成甲醛,甲醛与CH2(COOH)2在吡啶的催化下发生反应生成CH2=C(COOH)2,CH2=C(COOH)2发生脱羧反应生成丙烯酸(CH2=CH—COOH),合成路线如下![]() 。
。


科目:高中化学 来源: 题型:
【题目】大量排放氮的氧化物会产生酸雨、光化学烟雾等环境问题,工业上常用天然气还原法处理氮的氧化物。
(1) CH4催化还原NO 、NO2的热化学方程式如下:
序号 | 热化学方程式 |
① | 4NO2(g)+ CH4 (g) |
② | 4NO(g)+ CH4 (g) |
则4NO(g)![]() N2(g) +2NO2(g)的ΔH=___________________。
N2(g) +2NO2(g)的ΔH=___________________。
(2)T1℃时,在一密闭容器中发生反应4NO(g)![]() N2(g) +2NO2(g),其正反应速率表达式为:v正= k正·cn(NO),测得速率和浓度的关系如下表。
N2(g) +2NO2(g),其正反应速率表达式为:v正= k正·cn(NO),测得速率和浓度的关系如下表。
序号 | c(NO)/mol·L-1 | v正/mol·L-1·s-1 |
① | 0.10 | 4.00×10-9 |
② | 0.20 | 6.40×10-8 |
③ | 0.30 | 3.24×10-7 |
则n=_____________,k正=________________mol-3·L3·S-1。达到平衡后,若减小压强,则混合气体的平均相对分子质量将_______________(填“增大”、“减小”或“不变”)。
(3)利用测压法在刚性密闭容器中研究T2℃时4NO(g)![]() N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
反应时间/min | 0 | 10 | 20 | 30 | 40 |
压强/MPa | 15.00 | 14.02 | 13.20 | 12.50 | 12.50 |
①20 min时,NO的转化率α =____________﹪。
②T2℃时4NO(g)![]() N2(g)+2NO2(g)反 应的平衡常数Kp=_______MPa-1 (Kp为以分压表示的平衡常数)。若升高温度,该反应的平衡常数Kp将______ (填“增大”、“减小”或“不变”) 。
N2(g)+2NO2(g)反 应的平衡常数Kp=_______MPa-1 (Kp为以分压表示的平衡常数)。若升高温度,该反应的平衡常数Kp将______ (填“增大”、“减小”或“不变”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对3A2(g)+B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的

A. a、b、c三点平衡常数的大小关系为:Kb>Kc >Ka
B. 达到平衡时B2的转化率大小为:b>a>c
C. 增大压强有利于AB3的生成,因此在实际生产中压强越大越好
D. 若起始量为![]() ,则在T2温度下,平衡时AB3的体积分数接近b点
,则在T2温度下,平衡时AB3的体积分数接近b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应 2HI(g)![]() H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(2)Bodensteins 研究了下列反应:2HI(g) ![]() H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为__________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为__________(以K和k正表示)。若 k正=0.0027 min-1,在 t=40min 时,v正=_________ min-1。
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示。当升高到某一温度时,反应重新达到平衡,相应的点依次为__________(填字母)和__________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.4 mol某气体的体积为9.8L,则该气体的摩尔体积为_____。
(2)标准状况下,测得1.92克某气体的体积为672mL,则此气体的相对分子质量为___。
(3)实验室用Na2CO3·10H2O晶体配制0. 5mol/L的Na2CO3溶液970mL,应称取Na2CO3·10H2O的质量是____。
(4)某学生欲用12mol·L-1浓盐酸和蒸馏水配制500 mL 0.3 mol·L-1的稀盐酸。
①该学生需要量取____mL上述浓盐酸进行配制。
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是____(填序号)。
a.用量筒量取浓盐酸时俯视观察凹液面
b.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
e.容量瓶洗涤干净后未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-丁醇(液体)中溶有一种杂质,现利用下列方法提纯1-丁醇,路线如下:

已知1-丁醇、乙醚的部分性质如下表所示:
物质 | 沸点 | 密度 | 溶解性 |
1-丁醇 | 117.7℃ | 0.81g/cm3 | 能溶于水,易溶于乙醚 |
乙醚 | 34.6℃ | 0.71g/cm3 | 微溶于水 |
(1)加入饱和NaHSO3溶液的目的是______。
(2)操作Ⅱ的名称是______。
(3)萃取、分液所用的玻璃仪器的名称是______。为使1-丁醇尽可能多地从水中转移到乙醚中,萃取时向装有1-丁醇水溶液的仪器中加入一定量的乙醚,______、静置、分液,并重复多次。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在一定条件下,可与苯发生化学反应的是( )
①浓硝酸②溴水③溴的四氯化碳溶液④酸性KMnO4溶液⑤氧气
A. ①⑤B. ②④C. ②③⑤D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.

(1)指出图中明显的错误________________;________________;
(2)A仪器的名称是________________;B仪器的名称是________________;
(3)萃取、分液实验中所用主要玻璃仪器的名称是________________,静置后分液的第一步操作是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com