
【题目】用铂电极电解一定浓度的下列物质的水溶液,在电解后的电解液中加适量水,就能使溶液浓度恢复到电解前浓度的是( )
A.AgNO3B.K2SC.Na2CO3D.CuSO4
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 10g质量分数为46%的乙醇溶液中,氢原子的总数约为1.2NA
B. 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA
C. 1L pH=13的NaOH溶液中含有OH-的数目一定为0.1 NA
D. 0.1molO2完全反应时,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】s轨道与s轨道重叠形成的共价键可用符号表示为σs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号表示为σp-p,请你指出下列分子中含有σs-sp 键的是( )
A.N2B.C2H4C.C2H2D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(g)+3Y(g)2Z(g)△H=﹣a kJmolˉ1 , 一定条件下,将1mol X和3mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol.下列说法正确的是( )
A.10min内,Y的平均反应速率为0.03 molLˉ1sˉ1
B.第10min时,X的反应速率为0.01 molLˉ1minˉ1
C.10min内,消耗0.2 mol X,生成0.4 mol Z
D.10min内,X和Y反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六种元素在周期表中的位置如图所示,下列说法不正确的是
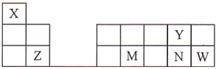
A. 原子半径:Z>M>Y
B. 气态氢化物的热稳定性:M>N
C. W的单质能氧化X、Y和N形成的某种化合物
D. X能与另外五种元素分别形成化合物,但X的化合价不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成的实验是
①检验自来水是否含氯离子 ②鉴别食盐和小苏打 ③蛋壳能否溶于酸 ④白酒中是否含甲醇
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是 ( )
A. 乙烯能使酸性高锰酸钾溶液褪色 B. 甲烷和氯气混合光照,黄绿色变浅
C. 将苯滴入溴水中,振荡后水层无色 D. 苯与氢气反应生成环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,涉及化学变化的是( )
A. 液氨用作制冷剂 B. 四氯化碳萃取碘水中的碘
C. 铁和铝遇到浓硝酸钝化 D. 蒸馏法将海水淡化为饮用水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据査危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是_______。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,可能发生氧化还原反应,下列反应可能发生的是_________。
A. NH4NO3![]() N2 +O2+H2O B. NH4NO3
N2 +O2+H2O B. NH4NO3![]() NH3+HNO3
NH3+HNO3
C. NH4NO3![]() O2 + HNO3 + H2O D. NH4NO3
O2 + HNO3 + H2O D. NH4NO3![]() N2 + HNO3+ H2O
N2 + HNO3+ H2O
E. NH4NO3 ![]() N2+ NH3+ H2O F. NH4NO3
N2+ NH3+ H2O F. NH4NO3![]() N2O+ H2O
N2O+ H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法。
①H2O2 处理法:NaCN + H2O2 ——N2↑+X + H2O,推测X的化学式为_______________。
②NaClO 处理法:aCN-+bC1O-+2cOH-= dCNO-+eN2↑+fCO32-+bCl-+cH2O方程式中e:f的值为____(填选项标号)。
A.1 B.1/2 C.2 D.不能确定
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与 NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL (设其中CN-的浓度为0.2 mol·L-1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:________________________;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com