
【题目】下列图中的实验方案,不能达到实验目的的是( )
A.依据2Fe3+(aq)+Cu(s)=Cu2+(aq)+2Fe2+(aq)设计如图甲装置的原电池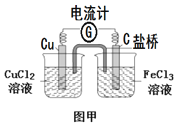
B.利用图乙装置验证氯化钠溶液(含酚酞)电解产物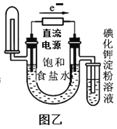
C.利用图丙装置测定中和热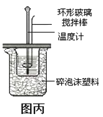
D.利用图丁装置探究浓度对化学反应速率的影响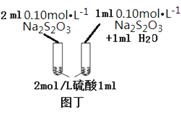
【答案】B
【解析】
A.因为2Fe3+(aq)+Cu(s)=Cu2+(aq)+2Fe2+(aq)为自发进行的氧化还原反应,所以可以设计如图甲装置的原电池,故A不符合题意;
B.由图乙装置中电子的流向可知,电子由电源的负极流向电解池的阴极,右端为阴极,产生氢气,不能用淀粉碘化钾溶液进行检验;左端为阳极,氯离子在阳极放电,生成氯气,需要用KI淀粉溶液来检验,不能达到实验目的,故B符合题意;
C. 为了减小热量的散失,两个大小烧杯口应该相平,且烧杯之间填充碎泡沫塑料,利用环形玻璃搅拌棒进行搅拌,反应迅速充分,利用图丙装置可以完成中和热的测定,故C不符合题意;
D.图丁装置是不同浓度的硫代硫酸钠和相同浓度硫酸反应的实验,可以用此装置探究浓度对化学反应速率的影响,故D不符合题意;
故答案:B。


科目:高中化学 来源: 题型:
【题目】—定条件下,向一带活塞的密闭容器中充入2 molSO2和1molO2,发生反应2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后改变下述条件,平衡时SO3气体的质量百分数不改变的是
2SO3(g),达到平衡后改变下述条件,平衡时SO3气体的质量百分数不改变的是
A. 保持温度和容器体积不变,充入1mol SO3(g)
B. 保持温度和容器内压强不变,充入1mol SO3(g)
C. 保持温度和容器内压强不变,充入1mol O2(g)
D. 保持温度和容器内压强不变,充入1mol Ar(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌洛托品在医药、染料等工业中有广泛应用,其结构式如图所示。将氨水与甲醛水溶液混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则氨与甲醛的物质的量之比为( )

A.1:1B.2:1C.2:3D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i CO2(g)+ 3H2(g) ![]() CH3OH(g)+ H2O(g) H1=Q kJ·mol-1
CH3OH(g)+ H2O(g) H1=Q kJ·mol-1
ii. CO2(g)+ H2(g) ![]() CO(g)+H2O(g) H2=+41 kJ·mol-1
CO(g)+H2O(g) H2=+41 kJ·mol-1
iii. CO(g)+2H2(g) ![]() CH3OH(g) H3= 99 kJ·mol-1
CH3OH(g) H3= 99 kJ·mol-1
回答下列问题:
(1)Q=_________
(2)图中能正确反映平衡常数K3(反应iii的平衡常数)随温度变化关系的曲线为__(填字母)
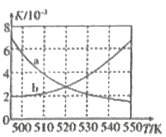
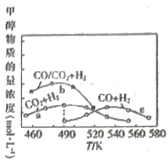
(3)如图为单位时间内CO2+H2、CO+ H2、CO/CO2+H2三个条件下生成甲醇的物质的量浓度与温度的关系(三个条件下通入的CO、CO2和H2的物质的量浓度相同)。490K时,根据曲线a、c判断合成甲醇时主要发生的反应为________(填“i”或“iii”);由曲线a可知,甲醇的量先增大后减小,其原因是_________________________________。
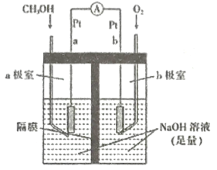
(4)如图是以NaOH溶液为电解质溶液的甲醇燃料电池:电极a的反应式为____________,若隔膜为阳离子交换膜,则每转移6mol电子,溶液中有_______mol Na+向____________(填“正极区”或“负极区")移动。
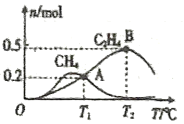
(5)CO2经催化加氢也可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应II :2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
在1L恒容密闭容器中充入2molCO2和4molH2测得平衡时有关物质的物质的量随温度变化如图所示。T1℃时,CO2的转化率为______。T1℃时,反应I的平衡常数K=_________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.4.0g由CO2和SO2组成的混合物中含有的质子数为2NA
B.1L0.5mol/LpH=7的CH3COONH4溶液中NH4+数目为0.5NA
C.常温下,0.1mol环氧乙烷(![]() )中含有的共价键数目为0.3NA
)中含有的共价键数目为0.3NA
D.22.4LCO2与足量Na2O2充分反应,转移的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
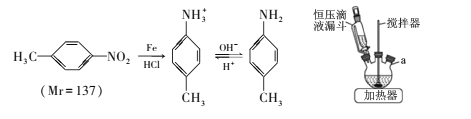
【题目】对甲基苯胺可用对硝基甲苯作原料在一定条件制得。 主要反应及装置如下:
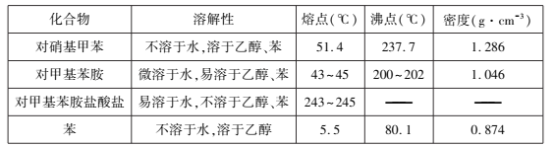
主要反应物和产物的物理性质见下表:
实验步骤如下:
①向三颈烧瓶中加入50mL稀盐酸、10.7mL(13.7g)对硝基甲苯和适量铁粉,维持瓶内温度在80℃左右,同时搅拌回流、使其充分反应;
②调节pH=7~8,再逐滴加入30mL苯充分混合;
③抽滤得到固体,将滤液静置、分液得液体M;
④向M中滴加盐酸,振荡、静置、分液,向下层液体中加入NaOH溶液,充分振荡、静置;
⑤抽滤得固体,将其洗涤、干燥得6.1g产品。
回答下列问题:
(1)主要反应装置如上图,a处缺少的装置是____ (填仪器名称),实验步骤③和④的分液操作中使用到下列仪器中的_____(填标号)。
a.烧杯 b.漏斗 c.玻璃棒 d.铁架台
(2)步骤②中用5%的碳酸钠溶液调pH =7~8的目的之一是使Fe3+ 转化为氢氧化铁沉淀,另一个目的是 ____。
(3)步骤③中液体M是分液时的____ 层(填“上”或“下”)液体,加入盐酸的作用是____。
(4)步骤④中加入氢氧化钠溶液后发生反应的离子方程式有____。
(5)步骤⑤中,以下洗涤剂中最合适的是____ (填标号)。
a.乙醇 b.蒸馏水 c.HCl溶液 d.NaOH溶液
(6)本实验的产率是_____%。(计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的原子最外层电子排布式是![]() ,该元素或其单质不可能具有的性质是( )
,该元素或其单质不可能具有的性质是( )
A.该元素的金属性比铝元素的强
B.该元素的单质在一定条件下能与盐酸反应
C.该元素位于第五周期ⅢA族
D.该元素的最高化合价为+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钾是一种剧毒物质,贮存和使用时必须注意安全。已知:![]() 。回答下列问题:
。回答下列问题:
(1)![]() 中所含三种元素的第一电离能从大到小的顺序为____________________(用元素符号表示,下同),电负性从大到小的顺序为__________,基态氮原子最外层电子排布式为__________。
中所含三种元素的第一电离能从大到小的顺序为____________________(用元素符号表示,下同),电负性从大到小的顺序为__________,基态氮原子最外层电子排布式为__________。
(2)与![]() 互为等电子体的分子为__________(任举一例)。
互为等电子体的分子为__________(任举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸(![]() )是制备感光树脂的重要原料,某肉桂酸粗产品中含有苯甲酸及聚苯乙烯,各物质性质如表:
)是制备感光树脂的重要原料,某肉桂酸粗产品中含有苯甲酸及聚苯乙烯,各物质性质如表:
名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) | 水中溶解度(25℃) |
苯甲醛 | 106 | -26 | 179.62 | 微溶 |
聚苯乙烯 | 104n | 83.1~105 | 240.6 | 难溶 |
肉桂酸 | 148 | 135 | 300 | 微溶(热水中易溶) |
实验室提纯肉桂酸的步骤及装置如下(部分装置未画出),试回答相关问题:
2g粗产品和30mL热水的混合物![]()
![]() 滤液
滤液![]()
![]() 称重
称重
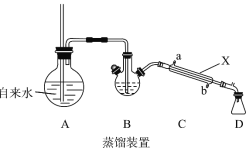
(1)装置A中长玻璃导管的作用是_________,步骤①使苯甲醛 随水蒸汽离开母液,上述装置中两处需要加热的仪器是____________(用字母 A、B、C、D回答)。
(2)仪器X的名称是_______,该装置中冷水应从___________口(填a或b)通入。
(3)步骤②中,10%NaOH溶液的作用是___________,以便过滤除去聚苯乙烯杂质。
(4)步骤④中,证明洗涤干净的最佳方法是________,若产品中还混有少量NaCl,进一步提纯获得肉桂酸晶体方法为_________________。
(5)若本实验肉桂酸粗产品中有各种杂质50%,加碱溶解时损失肉桂酸10%,结束时称重得到产品0.6g,若不计操作损失,则加盐酸反应的产率约为_____%(结果精确至0.1%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com