
【题目】研究表明:丰富的CO2可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H =+41.3kJ·mol-1
CO(g)+H2O(g) △H =+41.3kJ·mol-1
第二步:2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g) △H =-210.5kJ·mol-1
C2H4(g)+2H2O(g) △H =-210.5kJ·mol-1
①CO2加氢合成乙烯的热化学方程式为_____________________________。
②一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高CO2的转化率,可以采取的措施是______(填字母)。
A.减小压强 B.增大H2浓度 C.加入适当催化剂 D.分离出水蒸气
(2)另一种方法是将CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气。现在10L恒容密闭容器中投入1molCO2和2.75molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:

①能判断该反应达到化学平衡状态的是_______(填字母)。
a.c(H2):c(CH3OH)=3:1 b.容器内氢气的体积分数不再改变
C.容器内气体的密度不再改变 d.容器内压强不再改变
②上述反应的△H______0(填“>”或“<”),图中压强p1____p2(填“>”或“<”)。
③经测定知Q点时容器的压强是反应前压强的9/10,则Q点H2的转化率为____________。
④N点时,该反应的平衡常数K=______(计算结果保留两位小数)。
(3)用生石灰吸收CO2可生成难溶电解质CaCO3,其溶度积常数Ksp=2.8×10-9。现有一物质的量浓度为2×10-4mol/L纯碱溶液,将其与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为___mol/L。
【答案】2CO2+6H2(g) ![]() C2H4(g)+4H2O(g) △H= -127.9 kJ/mol B bd < > 20.5% 1.04 5.6×10-5
C2H4(g)+4H2O(g) △H= -127.9 kJ/mol B bd < > 20.5% 1.04 5.6×10-5
【解析】
(1)①根据两个反应方程式,消去CO,整理并计算反应的△H,正确答案:
2CO2+6H2(g) ![]() C2H4(g)+4H2O(g) △H= -127.9 kJ/mol。
C2H4(g)+4H2O(g) △H= -127.9 kJ/mol。
②减小压强,各物质的浓度减少,平衡左移,CO2的转化率降低,反应速率减慢,A错误;增大H2浓度,平衡右移,浓度增大,速率加快,CO2的转化率增大,B正确;加入适当催化剂,能够加快反应速率,但是平衡不动,CO2的转化率不变,C错误;分离出水蒸气,减少生成物浓度,速率减慢,但是平衡右移,CO2的转化率增大,D错误;正确选项B。
(2)①c(H2):c(CH3OH)=3:1 这仅仅是是反应的过程中一种情况,无法判定反应是否达平衡状态,a错误;容器内氢气的体积分数不再改变,可以判断反应达平衡状态,b正确;反应前后气体的总质量不变,容器的体积恒定,容器内气体的密度恒为定值,无法判定反应达到化学平衡状态,C错误;该反应为气体的总量减少的反应,当容器气体的总量不再发生变化,容器内的压强也不再改变,可以判定反应达到化学平衡状态,d正确;正确选项:bd。
②从图像看出,温度升高,n(CH3OH)减少,平衡左移,该反应正反应为放热反应,△H<0;当温度不发生改变,压强由p2→p1,增大压强平衡右移,n(CH3OH)增大,所以压强p1>p2,正确答案:< ; >。
③设二氧化碳的消耗量为xmol,根据方程式进行计算如下:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
起始量 1 2.75 0 0
变化量 x 3x x x
平衡量 1- x 2.75-3x x x
反应后气体总量为1-x+2.75-3x+x+x=(3.75-2x)mol,反应前气体总量为1+2.75=3.75 mol,根据压强比等于物质的量之比:(3.75-2x)/3.75=9/10, x=0.1875 mol, Q点H2的转化率为3×0.1875÷2.75×100%= 20.5%,正确答案:20.5%。
④ 10L恒容密闭容器中投入1molCO2和2.75mol,反应进行到506℃,达平衡状态,对应M点时,甲醇的量为0.25mol,进行如下计算:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
起始量 1 2.75 0 0
变化量 0.25 0.75 0.25 0.25
平衡量 0.75 2 0.25 0.25
各物质浓度分别为c(CO2)= 0.075 mol/L, c(H2)= 0.2 mol/L , c(CH3OH)= c(H2O)= 0.025 mol/L, 该反应的平衡常数K=(0.025)2/(0.23×0.075)= 1.04 ;由于N 和M处于同一温度下的不同曲线上两点,所以平衡常数相同,正确答案:1.04。
(3)设CaCl2溶液的最小浓度为为cmol/L,两溶液等体混合,溶液的浓度均减半,带入溶度积常数Ksp的计算公式:Ksp= c(Ca2+)c(CO32-)=(c÷2)×(2×10-4÷2)= 2.8×10-9,解之,c=5.6×10-5 mol/L;正确答案:5.6×10-5。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】某化学反应包括A(g)→B(g)、B(g)→C(g)两步反应,整个反应过程中的能量变化如图所示。下列说法正确的是( )

A.两步反应均为吸热反应
B.涉及的三种物质中C(g)最稳定
C.1mol C(g)与1mol A(g)的能量差为![]()
D.反应A(g)→B(g)一定要加热才能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲从含Br-的废液中提取溴单质,需经过一系列操作,实验装置及物质的性质如下:

Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3. 12 | 1.59 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
下列说法中正确的是
A. 可用装置甲氧化废液中的Br-
B. 装置乙中选用正十二烷而不用CCl4,是因为正十二烷的密度更小
C. 用装置丙进行蒸馏,先收集正十二烷再收集Br2
D. 用装置丁长期贮存液溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fritz Haber在合成氨领域的贡献距今已经110周年,氮族元素及其化合物应用广泛。
(1)在基态13N原子中,核外存在__________对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为__________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是________,与NO3-互为等电子体的分子为__________。液氨中存在电离平衡2NH3![]() NH4++NH2-,根据价层电子对互斥理论,可推知NH2-的空间构型为__________,液氨体系内,氮原子的杂化轨道类型为________。NH3比PH3更容易液化的原因为__________________。
NH4++NH2-,根据价层电子对互斥理论,可推知NH2-的空间构型为__________,液氨体系内,氮原子的杂化轨道类型为________。NH3比PH3更容易液化的原因为__________________。
(3)我国科学工作者实现世界首次全氮阴离子(N5-)金属盐Co(N5)2(H2O)4·4H2O的合成,其结构如图所示,可知N5-的化学键类型有______________。

(4)把特定物质的量之比的NH4Cl和HgCl2在密封管中一起加热时,生成晶体X,其晶胞的结构图及晶胞参数如图所示。则晶体X的化学式为__________,其晶体密度为__________(设阿伏加德罗常数的值为NA,列出计算式)g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验不能达到预期实验目的的是
序号 | 实验内容 | 实验目的 |
A. | 将2.5g CuSO4·5H2O溶解在97.5g 水中 | 配制质量分数为1.6%的CuSO4溶液 |
B. | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种更难溶的沉淀 |
D. | 分别向2支试管中加入5mL4%、5mL12%的过氧化氢溶液,再各加入几滴0.2mol·L-1FeCl3溶液 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 过量SO2通入到Ba(NO3)2溶液中:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+
B. Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+=Fe2++2H2O
C. H![]() O2中加入H2SO4酸化的KMnO4:5H
O2中加入H2SO4酸化的KMnO4:5H![]() O2+2MnO4-+6H+=518O2↑+2Mn2++8H2O
O2+2MnO4-+6H+=518O2↑+2Mn2++8H2O
D. 用铜电极电解硫酸铜溶液:2Cu2++2H2O![]() 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为9.2 mol·L-1
B. 1 mol Zn与足量该硫酸反应产生2 g氢气
C. 配制200 mL 4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种常用于橡胶硫化、有机物氯化的试剂,甲同学查阅资料:①将干燥的氯气在110~140 ℃ 间与硫反应,即可得S2Cl2粗品;②有关物质的部分性质如表所示:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77 | 137 | ①一种橙黄色的液体,遇水易水解,有淡黄色固体出现,同时产生能使品红溶液褪色的气体。 ②300 ℃以上完全分解。③S2Cl2+Cl2=2SCl2 |
设计如图所示实验装置在实验室合成S2Cl2:
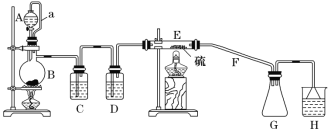
回答以下问题:
(1)仪器A的名称是_______________。
(2)B中所发生反应的离子方程式为___________________________________。
(3)C装置的作用是___________________________________ 。
(4)S2Cl2粗品中可能混有的杂质是_______________ (写其中一种,填化学式)。
(5)乙同学发现,该装置中除了E处的温度不能过高外,还有一处重大缺陷需改进,否则会导致S2Cl2的产率大大降低,原因是______________________________ (用化学方程式表示);请简要提出改进方案:________________________________________________。
(6)H中的溶液可以选择下列试剂中的__________ (填字母)。
A 碳酸钠溶液 B 氯化铁溶液 C 高锰酸钾溶液 D 亚硫酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.
A元素原子的核外p电子数比s电子数少3 |
B元素形成的物质种类繁多.其形成的一种固体单质工业上常用作切割工具 |
C元素基态原子p轨道有3个未成对电子 |
D原子核外所有p轨道全满或半满 |
E在该周期中未成对电子数最多 |
F能形成红色(或砖红色)和黑色的两种氧化物 |
某同学根据上述信息,推断
(1)画出A基态原子的核外电子排布图____________________。
(2)B基态原子的核外电子排布图![]() , 该同学所画的电子排布图违背了____________________________________。
, 该同学所画的电子排布图违背了____________________________________。
(3)D基态原子中能量最高的电子,其电子云在空间有____________个方向,原子轨道呈____________形。
(4)写出C原子的电子排布式 ____________;写出E原子的电子简化排布式____________。
(5)请写出F元素价电子排布式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com