
 CuSO4+SO2↑+2H2O ACE
CuSO4+SO2↑+2H2O ACE 2CuSO4+2H2O A
2CuSO4+2H2O A CO2↑+2SO2↑+2H2O CDEF
CO2↑+2SO2↑+2H2O CDEF CuSO4+SO2↑+2H2O,反应中硫元素化合价由+6降到+4,浓硫酸表现了强氧化性,同时有一部分H2SO4中各元素化合价均未改变,表现出了酸性,浓硫酸吸收了反应生成的水,使反应中有大量蓝色固体出现,表现了吸水性。(2)废铜屑倒入热的稀硫酸中并通入空气制备CuSO4溶液的反应方程式为2Cu+O2+2H2SO4
CuSO4+SO2↑+2H2O,反应中硫元素化合价由+6降到+4,浓硫酸表现了强氧化性,同时有一部分H2SO4中各元素化合价均未改变,表现出了酸性,浓硫酸吸收了反应生成的水,使反应中有大量蓝色固体出现,表现了吸水性。(2)废铜屑倒入热的稀硫酸中并通入空气制备CuSO4溶液的反应方程式为2Cu+O2+2H2SO4 2CuSO4+2H2O,硫酸表现出了酸性。
2CuSO4+2H2O,硫酸表现出了酸性。 CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验现象 | 推论 |
| A | 乙烯气体可以使溴水褪色 | 乙烯发生取代反应 |
| B | 浓硫酸电导率比较低 | 硫酸浓度大时是弱电解质 |
| C | 氨气用于喷泉实验 | 氨气极易溶于水 |
| D | 硝酸溶液使pH试纸先变红后变白 | 硝酸酸性太强不能用pH试纸检测 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
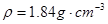 ) 60mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
) 60mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯水中通入一定量二氧化硫气体可增强氯水的漂白性 |
| B.含有酚酞的氢氧化钠溶液中通入二氧化硫气体,溶液变无色,说明二氧化硫具有漂白性 |
| C.二氧化硫既可被氧化也可被还原 |
| D.紫色石蕊试液中通入二氧化硫,溶液先变红后退色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.根据元素分析结果推测该粉末为纯净物 |
| B.将该粉末溶于水,加入氯化钡,有白色沉淀生成,证明该粉末中含有K2SO4 |
| C.将该粉末加入盐酸中,产生气泡,证明该粉末是K2SO3粉末 |
| D.将该粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成,证明该粉末是K2SO4和K2SO3的混合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.水 | B.饱和NaHSO3溶液 | C.酸性KMnO4溶液 | D.NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.要清洗附着在试管壁上的硫,可用的试剂是CS2 |
| B.硫化亚铁溶于稀硝酸中反应的离子方程式为:FeS+2H+=Fe2++H2S↑ |
| C.常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 |
| D.在Na2SO3和BaCO3混合物中加入过量的稀硫酸,能产生气泡并有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铜与浓硫酸共热 |
| B.用铜片为阳极,石墨为阴极,电解稀硫酸 |
| C.先灼烧废铜屑生成氧化铜,然后再用浓硫酸溶解 |
| D.适当温度下,使铜片在持续通入空气的稀硫酸中溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com