
【题目】氮和碳一样也存在一系列氢化物如NH3、N2H4、N3H5、N4H6等。
(1)N3H5的电子式为_______。
(2)已知4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=a kJ/mol K1①;
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=b kJ/mol K2②;
写出N2与O2反应生成1 mol NO气体的热化学方式程式为________________________;
(3)已知NH3·H2O为一元弱碱,N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O+H2O![]() N2H5·H2O++OH-,则可溶性盐盐酸肼(N2H6Cl2)溶液中离子浓度由大到小的顺序为___________________________________。
N2H5·H2O++OH-,则可溶性盐盐酸肼(N2H6Cl2)溶液中离子浓度由大到小的顺序为___________________________________。
(4)如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
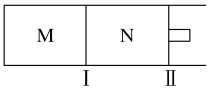
①向M、N中,各通入2 mol N2和6 mol H2。初始M、N容积相同,并保持温度不变。则到达平衡时H2的转化率α(H2)为M________N(填“>”“=”“<”)。
②若在某条件下,反应N2(g)+3H2(g)![]() 2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4 mol H2、0.2 mol NH3,此时容积为2.0 L。则此条件下的平衡常数为_______。
2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4 mol H2、0.2 mol NH3,此时容积为2.0 L。则此条件下的平衡常数为_______。
【答案】![]() 1/2N2(g)+1/2O2(g)=NO(g) ΔH2=(a-b)/4 kJ/mol c(Cl-)>c(N2H62+)> c(H+) >c(N2H5·H2O+)>c(OH-) < 2.5
1/2N2(g)+1/2O2(g)=NO(g) ΔH2=(a-b)/4 kJ/mol c(Cl-)>c(N2H62+)> c(H+) >c(N2H5·H2O+)>c(OH-) < 2.5
【解析】
(1)根据NH3、N2H4、N3H5、N4H6等一系列化学式可推出其通式为NnHn+2;其中N3H5为共价化合物,根据氮原子成3键,氢原子成1键规律可知N3H5的电子式为![]() ;
;
综上所述,本题答案是:![]() 。
。
(2)已知反应①和反应②,根据要求的反应是N2与O2反应生成NO气体,依据盖斯定律(①-②)/4即得1/2N2(g)+1/2O2(g)=NO(g) ΔH2=(a-b)/4 kJ/mol;
综上所述,本题答案是:1/2N2(g)+1/2O2(g)=NO(g) ΔH2=(a-b)/4 kJ/mol。
(3)已知N2H4·H2O为二元弱碱,则可溶性盐盐酸肼(N2H6Cl2)的第一步水解的离子方程式为N2H62++H2O![]() N2H5·H2O++H+;溶液中离子浓度由大到小的顺序为c(Cl-)>c(N2H62+)> c(H+) >c(N2H5·H2O+)>c(OH-);
N2H5·H2O++H+;溶液中离子浓度由大到小的顺序为c(Cl-)>c(N2H62+)> c(H+) >c(N2H5·H2O+)>c(OH-);
综上所述,本题答案是:c(Cl-)>c(N2H62+)> c(H+) >c(N2H5·H2O+)>c(OH-)。
(4)①已知化学平衡N2(g)+ 3H2(g) ![]() 2NH3(g),这是一个气体体积缩小的反应,由于隔板I固定不动,活塞II可自由移动,所以M中压强减小,N中压强不变,即M相对于N是减小压强,则平衡向左移动,使氢气的转化率减小,即aM(H2)<aN(H2),即M<N;
2NH3(g),这是一个气体体积缩小的反应,由于隔板I固定不动,活塞II可自由移动,所以M中压强减小,N中压强不变,即M相对于N是减小压强,则平衡向左移动,使氢气的转化率减小,即aM(H2)<aN(H2),即M<N;
综上所述,本题答案是:<。
②若在某条件下,反应N2(g)+3H2(g)![]() 2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4molH2、0.2mol NH3,此时容积为2.0 L。则此条件下的平衡常数为
2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4molH2、0.2mol NH3,此时容积为2.0 L。则此条件下的平衡常数为
平衡后各物质浓度分别为:c(N2)=1.0 mol÷2.0 L=0.5 mol/L;c(H2)= 0.4mol÷2.0L=0.2 mol/L,c(NH3)= 0.2mol÷2.0L=0.1mol/L;根据K= c2(NH3)/c(N2)c3(H2)=0.12/0.5×0.23=2.5;
综上所述,本题答案是:2.5。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程。
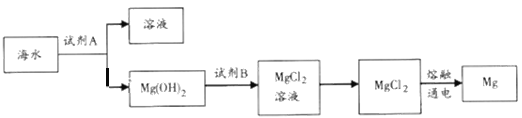
①工业上常用于沉淀Mg2+的试剂A是__________(填化学式),Mg(OH)2转化为MgCl2的离子方程式为________________________。
②由无水MgCl2制取Mg的化学方程式是______________________。
(2)海带灰中富含以I-形式存在的碘元素,实验室提取I2的途径如下所示:
![]()
①灼烧海带至灰烬时所用的主要仪器是__________(填名称);
②向酸化的滤液中加过氧化氢溶液,该反应的离子方程式为__________;
③反应结束后,加入CCl4作萃取剂,采用萃取-分液的方法从碘水中提取碘,主要操作步骤如下图:
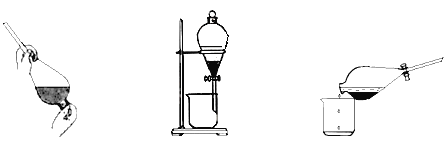
甲.加入萃取剂后振荡 乙.静置分层 丙.分离
甲、乙、丙3步实验操作中,错误的是__________(填“甲”、“乙”或“丙”)。
(3)海水中部分离子的含量如下:
成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
若从100L该海水中提取镁,理论上需加入试剂A__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是
A. CH3OH(l)+3/2O2(g) ![]() CO2(g)+2H2O(l) ;ΔH=+725.8 kJ·mol-1
CO2(g)+2H2O(l) ;ΔH=+725.8 kJ·mol-1
B. 2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) ;ΔH=-1 452 kJ·mol-1
2CO2(g)+4H2O(l) ;ΔH=-1 452 kJ·mol-1
C. 2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) ;ΔH=-725.8 kJ·mol-1
2CO2(g)+4H2O(l) ;ΔH=-725.8 kJ·mol-1
D. 2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) ; ΔH=+1 452 kJ·mol-1
2CO2(g)+4H2O(l) ; ΔH=+1 452 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
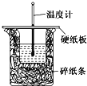
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________,烧杯间填满碎泡沫塑料的作用是________________________。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值__(填“偏大”、“偏小”或“无影响”)。
(3)实验中若改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热的数值______(填“相等”或“不相等”),理由是_______________________________。
(4)三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为2.3 ℃、2.4 ℃、2.9 ℃,则最终代入计算式的温度差的平均值为_____℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F、G是原子序数依次增大的六种短周期元素。A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15。回答下列问题:
(1)E元素在元素周期表中的位置是__________;A离子的结构示意图为____________。
(2)D的单质与B的最高价氧化物对应水化物的溶液反应,其离子方程式为__________。
(3)①B2A2中含有___________键和_________键,其电子式为__________。
②该物质与水反应的化学方程式为_______________。
(4)下列说法正确的是__________(填字母序号)。
①B、D、E原子半径依次减小
②六种元素的最高正化合价均等于其原子的最外层电子数
③D的最高价氧化物对应水化物可以溶于氨水
④元素气态氢化物的稳定性:F>A>G
(5)在E、F、G的最高价氧化物对应水化物中,酸性最强的为_________(填化学式),用原子结构解释原因:同周期元素电子层数相同,从左至右,_________,得电子能力逐渐增强,元素非金属性逐渐增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是( )

A. 该反应为吸热反应
B. 该反应不需要加热就能进行
C. 1 molCO(g)和1mol H2O(g)具有的总能量大于1 molCO2(g)和1 molH2(g)具有的总能量
D. 1 molCO2(g)和1 molH2(g)反应生成1 molCO(g)和1mol H2O(g)要放出41 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验编号 | 0.1mol/L酸性KMnO4溶液的体积/mL | 0.6mol/LH2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
① | 10 | V1 | 35 | 25 | |
② | 10 | 10 | 30 | 25 | |
③ | 10 | 10 | V2 | 50 |
(1)表中V1=_______mL,V2=_______mL。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com