
【题目】全钒氧化还原电池是一种新型可充电电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+- e-=V3+,下列说法正确的是( )

A.放电时,右槽发生还原反应
B.放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C.充电时,每转移1mol电子,1 mol H+从右槽迁移向左槽
D.充电时,阴极电解液pH升高
【答案】B
【解析】
根据电解装置分析可知,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,发生氧化反应,为原电池负极反应,则左槽为原电池正极,发生还原反应,电极方程式应为VO2++2H++e-=VO2++H2O,充电时电极反应为放电电极反应的逆反应,以此解答该题
A.根据上述分析可知,电池放电时,右槽中的电极反应为:V2+-e-=V3+,发生氧化反应,A选项错误;
B.放电时,左槽发生还原反应,电极方程式应为VO2++2H++e-=VO2++H2O,B选项正确;
C.充电时,左槽电极反应式为VO2++H2O-e-=VO2++2H+,每转移1mol电子,2mol H+从左槽迁移向右槽,C选项错误;
D.充电时,H+从左槽(阳极)迁移向右槽(阴极),则阴极电解液pH降低,D选项错误;
答案选B。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(1)已知,亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,则H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①_____________________________,②__________________________________。
(2)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况______________,写出化学方程式:____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在好氧菌和厌氧菌作用下,废液中NH4+能转化为N2(g)和H2O(1),示意图如下:
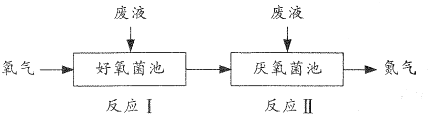
反应I:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) △H1=akJ·mol-1
反应Ⅱ:5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) △H2=bkJ·mol-1
下列说法正确的是
A.两池发生的反应中,氮元素只被氧化
B.两池中投放的废液体积相等时,NH4+能完全转化为N2
C.常温常压下,反应Ⅱ中生成22.4 L N2转移的电子数为3.75NA
D.4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) △H=![]() (3a+b) kJ·mol-1
(3a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)和亚硫酰氯(SOCl2)常用作氯化剂,都可用于医药、农药、染料工业及有机合成工业。亚硫酰氯还用于制锂亚硫酰氯(Li/SOCl2)电池。
有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 具有吸水性且难分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为:SO2(g)+Cl2(g) ![]() SO2Cl2(l) △H= - 97.3 kJ·mol-1。反应装置如图所示(夹持仪器已省略),请回答有关问题:
SO2Cl2(l) △H= - 97.3 kJ·mol-1。反应装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A的名称为___________;
(2)仪器B的作用是_____________________;
(3)装置丙中盛放的试剂为____________,在实验室用氢氧化钠吸收多余硫酰氯反应的离子方程式为___________________;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_________(填序号)
①先通冷凝水,再通气体 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的实验操作名称为__________________,
②设计实验方案检验氯磺酸分解制取硫酰氯产品中混有硫酸,下列方案合理的是:_____(填字母)
A.取样品溶于水,滴加紫色石蕊溶液变红:再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4。
B.取样品在干燥条件下加热至完全反应,冷却后直接加BaCl2溶液,有白色沉淀,再滴加紫色石蕊溶液变红,说明含有H2SO4。
(6)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质溶液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+SO2。
①写出该电池正极发生的电极反应式_______________________________
②组装该电池必须在无水、无氧的条件下进行,原因是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属元素Fe、Ni、Pt均为周期表中同族元素,该族元素的化合物在研究和生产中有许多重要用途。
(1)Fe是常见的金属,生活中用途广泛。请回答下列问题:
①Fe在元素周期表中的位置为________________________。
②Fe的一种晶胞结构如图所示,测得晶胞边长为 a pm,则Fe原子半径为__________。
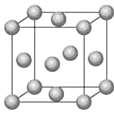
③已知:FeO晶体晶胞结构为NaCl型,与O2-距离最近且等距离的亚铁离子围成的空间构型为________。
(2)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配体是_________;该配合物有两种不同的颜色,其中橙黄色比较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如下图所示的结构示意图中呈亮黄色的是_____(填“A”或“B”),理由是___________。
A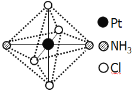 B
B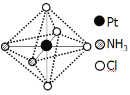
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图。
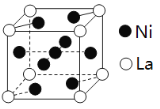
①测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为____________ (不必计算结果) 。
②储氢原理为:镧镍合金吸附H2,H2解离为原子,H原子储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心,则形成的储氢化合物的化学式为____________。
(4)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用![]() 表示,其中m、n分别代表参与形成大π键的电子数和原子个数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的电子数和原子个数,如苯分子中大π键表示为![]() 。 下列微粒中存在“离域Π键”的是__________。
。 下列微粒中存在“离域Π键”的是__________。
a.O3 b.SO42- c.H2S d.NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】来自石油的有机化工原料A,可以发生如下转化:
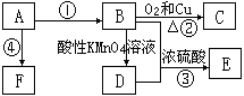
已知:E是具有果香味的有机物,F是一种高分子化合物。请回答下列问题。
(1)A的分子式是_____,C的名称是_____。
(2)D分子中的官能团名称是_____。
(3)反应③的化学方程式是_____,该反应属于_____反应。反应④的化学方程式是_____,该反应属于_____反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
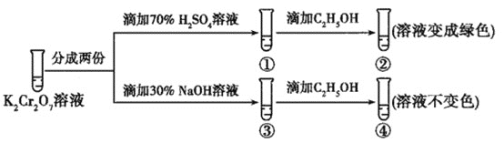
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
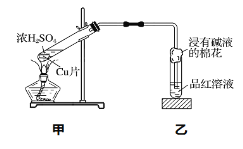
(1)甲装置中发生的主要反应的化学方程式是____________。
(2)装置乙中的品红溶液褪色证明SO2具有_______性。
(3)在装置乙的试管口放有一团浸有碱液的棉花,棉花中通常浸有饱和碳酸钠溶液或氢氧化钠溶液,请写出SO2与NaOH溶液反应的离子方程式:_____________。
(4)欲观察生成的CuSO4溶液的颜色,应采取的操作是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,用两根金属Pt作电极插入KOH溶液中,然后向两极分别通入甲烷和氧气,其电极反应式为X极:CH4+10OH--8e-=CO32—+7H2O; Y极:4H2O+2O2+8e-=8OH-。下列关于此燃料电池的说法中,错误的是
A.X为负极,Y为正极
B.该电池工作时,X极附近溶液的碱性增强
C.在标准状况下,通入 5.6 L O2完全反应后,有1 mol电子发生转移
D.工作一段时间后,KOH的物质的量减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com