
【题目】下列各组金属和液体(配有导线),能组成原电池的是( )
A. Cu、Cu、稀硫酸 B. C. Pt、氯化钠溶液
C.Cu、Zn、酒精
D. Fe、Cu、FeCl3溶液
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 | 目的 | 分离方法 | 原理 |
A | 除去KCl中的MnO2 | 蒸发结晶 | 溶解度不同 |
B | 分离食用油和汽油 | 分液 | 食用油和汽油的密度不同 |
C | 分离KNO3和NaCl | 重结晶 | KN03的溶解度大于NaCl |
D | 除去碘中的NaCl | 加热、升华 | NaCl的熔点高,碘易升华 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不符合第ⅦA族元素性质特征的是( )
A. 从上到下元素的非金属性增强 B. 易形成-1价离子
C. 最高价氧化物的水化物显酸性(氟除外) D. 从上到下氢化物的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(18分)Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O35H2O
反应原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml 乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。

③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:
。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 molL1碘的标准溶液滴定。
反应原理为:2S2O32+I2=S4O62-+2I
(5)滴定至终点时,溶液颜色的变化: 。
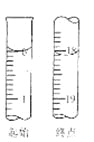
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。产品的纯度为(设Na2S2O35H2O相对分子质量为M) 。
III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42,常用作脱氧剂,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
扁桃酸衍生物是重要的医药中间体,以A和B 为原料合成扁桃酸衍生物F路线如图:

图1
(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为_______________,写出A+B→C的化学反应方程式为_____________________________;
(2)C( )中①、②、③3个-OH的酸性由强到弱的顺序是_______________;
)中①、②、③3个-OH的酸性由强到弱的顺序是_______________;
(3)E是由2分子C生成的含有3个六元环的化合物,E分子中不同化学环境的氢原子有____________种。
(4)D→F的反应类型是_____________,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为__________mol。
(5)写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式:_______________。
①属于一元酸类化合物
②苯环上只有2个取代基且处于对位,其中一个是羟基
(6)已知:R-CH2-COOH![]()

A有多种合成方法,写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:
H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5_______________________________。
CH3COOC2H5_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于自发进行的变化是 ( )
A.红墨水加到清水使整杯水变红B.冰在室温下融化成水
C.NaHCO3 转化为 Na2CO3D.铁器在潮湿的空气中生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 原电池是把电能转变成化学能的装置
B. 原电池中电子流出的一极是正极,发生氧化反应
C. 原电池两极均发生氧化反应和还原反应
D. 原电池内部的阳离子向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是

A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A是五元环状化合物,相对分子质量为98,其中氧元素的质量分数为49%,其核磁共振氢谱只有一个峰;反应⑤是加成反应;G是一种合成橡胶和树脂的重要原料。有关物质的转化关系如图所示:

已知:(其中R是烃基)
①
![]() 2RCOOH ②RCOOH
2RCOOH ②RCOOH![]() RCH2OH
RCH2OH
请回答以下问题:
(1)G的名称为____________________。
(2)B中官能团的名称是______________,④的反应类型是_______________。
(3)E可在一定条件下生成高分子化合物,写出该高分子化合物可能的结构简式:_______________。
(4)F属于酯类,反应⑥的化学方程式为_____________________________。
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式___________________。
(6)写出由G合成2-氯-1,3-丁二烯的合成路线(无机试剂任选):__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com