
【题目】火法炼铜是目前世界上最主要的冶炼铜的方法,其产量可占到铜总产量的85%以上,火法炼铜相关的方程式有
Cu2S(s)+O2(g)=2Cu(s)+SO2(g) ΔH1=-271.4kJ/mol 反应①
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g) ΔH2=+123.2kJ/mol 反应②
(1)Cu2S(s)在空气中煅烧生成Cu2O(s)和SO2(g)的热化学方程式是__。
(2)在2L的恒温密闭容器中通入5mol氧气并加入足量Cu2S发生反应①(不考虑其它反应),容器中的起始压强为akPa,反应过程中某气体的体积分数随时间变化如图所示,反应前3min平均反应速率v(SO2)=__mol/(L·min),该温度下反应的平衡常数KP=__(KP为以分压表示的平衡常数)。若保持温度不变向平衡体系中再通入1mol氧气,达到新平衡后氧气的体积分数__(填“大于”“小于”或“等于”)原平衡时氧气的体积分数。
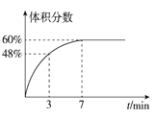
【答案】2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH=-937.4kJ/mol 0.4 1.5 等于
【解析】
(1)根据盖斯定律计算反应热并书写热化学方程式;
(2)根据速率表达式v(SO2)=![]() ,平衡常数
,平衡常数![]() 及平衡移动原理分析解答。
及平衡移动原理分析解答。
(1)Cu2S(s)在空气中煅烧生成Cu2O(s)和SO2(g)的反应方程式为:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g),根据盖斯定律得此反应可由反应①×3-反应②得到,所以反应热为(-271.4kJ/mol×3)-123.2kJ/mol=-937.4kJ/mol,根据热化学方程式书写规则可得该反应热化学方程式为:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH=-937.4kJ/mol,故答案为:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH=-937.4kJ/mol;
(2)根据图示知曲线为SO2的体积分数,反应过程中气体体积不变,则3min时,生成二氧化硫的物质的量为n=5mol×48%=2.4mol,则v(SO2)= ;反应在7min后达到平衡,此时SO2的体积分数为60%,根据平衡常数的表达式得:
;反应在7min后达到平衡,此时SO2的体积分数为60%,根据平衡常数的表达式得:![]() ;该反应前后气体体积不变,则通入氧气时,平衡不移动,转化率不变,则氧气的体积分数等于原平衡时氧气的体积分数,故答案为:0.4;1.5;等于。
;该反应前后气体体积不变,则通入氧气时,平衡不移动,转化率不变,则氧气的体积分数等于原平衡时氧气的体积分数,故答案为:0.4;1.5;等于。


科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.2mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
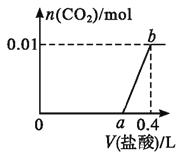
A.在0~a范围内,只发生反应OH-+H+=H2O
B.a=0.35
C.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素间形成的化合物如“![]() 、
、![]() 、
、![]() ”等称为卤素互化物,化学性质与卤素单质类似,则下列关于卤素互化物的性质的描述及发生的相关反应不正确的是( )
”等称为卤素互化物,化学性质与卤素单质类似,则下列关于卤素互化物的性质的描述及发生的相关反应不正确的是( )
A.![]() 是一种化合物B.
是一种化合物B.![]()
C.![]() 的氧化性强于
的氧化性强于![]() D.
D.![]() 可以与
可以与![]() 溶液反应生成2种盐
溶液反应生成2种盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的处理。
(1)为检测PAFC中铝和铁元素的含量,采用如图所示流程进行:
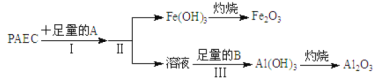
回答下列问题:
①PAFC中铁元素的化合价为__________。
②步骤I中的试剂A是__________ (从氢氧化钠溶液、氨水中选择)步骤III中的试剂B是__________。
③步骤II的操作是__________。
(2)某工厂欲以工业废料(铁、铁和铝的氧化物)为原料制取PAFC,设计如下流程:
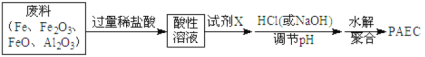
①所得酸性溶液中,不能确定是否一定存在的阳离子是_________(填序号)。
A.Al3+ B.Fe2+ C.Fe3+ D.H+
为证明该离子确实存在,可采用的操作(必须指明所采用的试剂及观察到的现象)是:_____。
②往酸性溶液中加入试剂X的目的是(用离子方程式表示)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)电镀厂的废水中含有的CN有剧毒,需要处理加以排放。处理含CN废水的方法之一是在微生物的作用下,CN被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为__。
(2)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A表示乳酸根离子):
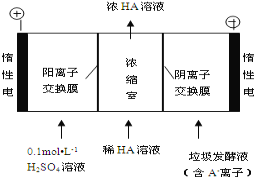
①阳极的电极反应式为___。
②简述浓缩室中得到浓乳酸的原理:__。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH可忽略不计。400mL10g/L乳酸溶液通电一段时间后,浓度上升为145g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为__L(提示:乳酸的摩尔质量为90g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是我们熟悉的典型非金属元素,研究氮及其化合物的性质对于生产、生活、科研具有重要意义,请回答以下问题:
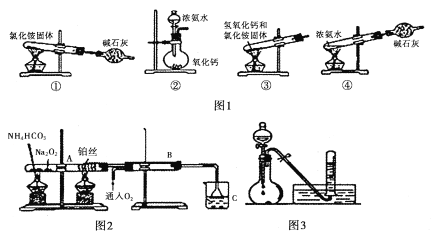
I. (1)图1为制取氨气的装置和选用的试剂,其中合理的是______________(填字母)。
A,①② B. ②③ C. ②④ D. ①③
(2)实验室制备氨气的化学方程式是____________________________________。
II. 图2位铵盐的受热分解装置
(1)被加热的铂丝处发生反应的化学方程式为____________________________________。
(2)B中出现的现象为_______________________________________________________。
(3)如图3:将上述烧杯C中反应得到酸的足量的浓溶液与Cu反应,实验完毕后,试管中收集到气体的主要成分为____________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,既含有离了键,又含有共价键的物质是__________,属于共价化合物的是__________。
(2)用电子式表示CaCl2的形成过程:____________________。
(3)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用产生NH3。请写出Na3N的电子式是__________。
(4)Na3N与盐酸反应生成两种盐,反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:
①固体NaOH;②固体KOH;③固体NaHSO4;④固体CH3COONa;⑤冰醋酸
其中一定可使c(CH3COO-)/c(Na+)比值增大的是 ( )
A. ①② B. ②⑤ C. ①⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物(ZXY)2的结构式如图所示。下列叙述不正确的是( )
![]()
A.化合物(ZXY)2中Z元素的化合价为-2价
B.Y的氧化物对应的水化物可能是弱酸
C.(ZXY)2分子中X原子的杂化方式为sp杂化
D.X、Y、Z、W四种元素电负性的大小顺序为:Z>Y>X>W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com