
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
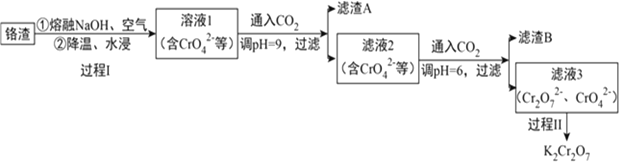
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是_______。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质可以循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
Cr2O72-+H2O K=4.0×1014滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。下表是不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 373 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:向滤液③中加入稀盐酸和KCl固体后,_____________,过滤,得到K2Cr2O7粗品。
【答案】还原性 AlO2- OH- 0.3mol 2Al2O3(熔融) 3O2↑+4Al NaHCO3 0.01 蒸发浓缩、降温结晶
3O2↑+4Al NaHCO3 0.01 蒸发浓缩、降温结晶
【解析】
利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,铬渣加入熔融NaOH、空气,降温水浸,铝、氧化铝溶解生成偏铝酸钠,Cr2O3溶解得到CrO42-,得到溶液Ⅰ中含有CrO42-、AlO2-、OH-,通入二氧化碳调节溶液pH=9沉淀铝离子生成氢氧化铝沉淀,滤渣A为氢氧化铝,滤液2继续通入二氧化碳调节溶液pH=6过滤得到,滤渣B为碳酸氢钠晶体,滤液3含Cr2O72-、CrO42-等,过程Ⅱ的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7,
(1)铝热反应中铝失电子作还原剂。
(2)铝、氧化铝溶解生成偏铝酸钠,Cr2O3溶解得到CrO42-,得到溶液Ⅰ中含有CrO42-、AlO2-、OH-。
(3)在Cr2O3参与的反应中,若生成0.4mol CrO42-,反应的离子方程式为:2Cr2O3+8OH-+3O2=4CrO42-+4H2O,据此计算,反应的氧化剂氧气物质的量为0.3mol;
(4)①电解熔融氧化铝生成铝和氧气,化学方程式为2Al2O3(熔融) 3O2↑+4Al。
3O2↑+4Al。
②滤渣B受热分解所得物质可以循环利用是碳酸氢钠分解生成的碳酸钠,B为碳酸氢钠晶体。
③已知:2CrO42-+2H+=Cr2O72-+H2O K=4.0×1014,滤液3中Cr2O72-的浓度是0.04mol/L,K=![]() ,氢离子浓度c(H+)=10-6mol/L,CrO42-的浓度=
,氢离子浓度c(H+)=10-6mol/L,CrO42-的浓度=![]() ,经计算得c =
,经计算得c = ![]() 。
。
(5)过程Ⅱ得到K2Cr2O7粗品是溶液中得到溶质固体,利用物质溶解度分析,K2Cr2O7溶解度比Na2Cr2O7 小,加入氯化钾和稀盐酸蒸发浓缩、降温结晶得到晶体。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】(乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)26H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为___。
(2)NO3-中氮原子轨道的杂化类型是___。
(3)与HNO2互为等电子体的一种阴离子的化学式为___。
(4)配合物[Mn(CH3OH)6]2+中配位原子是___。
(5)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有___。
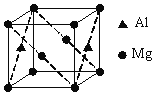
(6)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
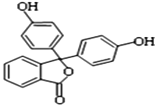
A. 核磁共振氢谱中有5个峰
B. 最多有15个碳原子共平面
C. 可能发生缩聚反应生成高分子化合物
D. 1mol该物质最多能与含4molNaOH的烧碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2―→2HCl +2COCl2。下列说法不正确的有

A. CHCl3分子的空间构型为正四面体
B. COCl2分子中中心C原子采用sp2杂化
C. COCl2分子中所有原子的最外层电子都满足8电子稳定结构
D. 使用前可用硝酸银稀溶液检验氯仿是否变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.C60、C70、碳纳米管互为同素异形体B.H、D、T互为同位素,中子数都为1
C.C4H10O与C2H6O一定互为同系物D.C4H10的一氯代物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______方法区分晶体、准晶体和非晶体。
(2)基态 Fe原子有_______个未成对电子,Fe3+的电子排布式为 _____,可用硫氰化钾检验Fe3+,形成的配合物的颜色为________ 。
(3)新制备的Cu(OH)2可将乙醛〔CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为____________,乙酸的沸点明显高于乙醛,其主要原因是________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_____ 。列式表示Al单质的密度___________g·cm-3(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,已知下列三种金属硫化物的溶度积常数(Ksp)分别为Ksp(FeS)=6.3×10-18;Ksp(CuS)=1.3×10-36;Ksp(ZnS)=1.6×10-24。下列关于常温时的有关叙述正确的是( )
A. 硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B. 将足量的ZnSO4晶体加入到0.1 mol·L-1的Na2S溶液中,Zn2+的浓度最大只能达到1.6×10-23mol·L-1
C. 除去工业废水中含有的Cu2+,可采用FeS固体作为沉淀剂
D. 向饱和FeS溶液中加入FeSO4溶液后,混合液中c(Fe2+)变大、c(S2-)变小,Ksp(FeS)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。
(2)B中质子数和中子数相等的核素符号为____,E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是______L(标准状况下)。
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com