
【题目】酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
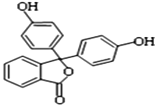
A. 核磁共振氢谱中有5个峰
B. 最多有15个碳原子共平面
C. 可能发生缩聚反应生成高分子化合物
D. 1mol该物质最多能与含4molNaOH的烧碱溶液反应
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是( )
A.氯化铝溶液和过量氨水生成氢氧化铝
B.镁在二氧化碳中燃烧生成碳酸镁
C.向苯酚溶液中滴入Na2CO3溶液,产生气泡
D.铁与高温水蒸气反应生成氧化铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“测定1mol气体体积”的实验中,我们通常选择的测量气体是氢气,反应是镁和稀硫酸反应。图中的A、B、C三部分能组成气体摩尔体积测定装置:

(1)C装置的名称是___________________。
(2)A、B、C装置接口的连续顺序是_________________。
(3)该装置正确连接后怎样做气密性检查?_________________。
(4)本实验中有两次针筒抽气,需要记录的是第____次抽出气体的体积。
(5)下表是某同学记录的实验数据:温度:25℃,气压:101.3kPa
实验次数 | 镁带质量(g) | 硫酸体积(mL) | C瓶读数(mL) | 抽出气体的体积(mL) |
1 | 0.115 | 10.0 | 124.8 | 7.0 |
2 | 0.110 | 10.0 | 120.7 | 6.2 |
计算两次实验1mol氢气的体积的平均值=____L(保留一位小数,镁的相对原子质量为24.3)。
(6)已知实验温度下,1mol氢气的体积的理论值为24.5L,实验误差=____%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了体育大型比赛的公平和发扬积极向上健康精神,禁止运动员使用兴奋剂是奥运会的重要举措之一。以下两种兴奋剂的结构分别为:
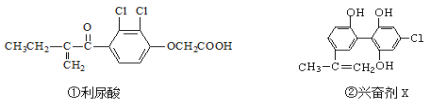
则关于以上两种兴奋剂的说法中正确的是( )
A. 利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰
B. 两种兴奋剂最多都能和含3molNaOH的溶液反应
C. 1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2
D. 两种分子中的所有碳原子均不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型示意图,下列说法正确的是

A. 甲能发生氧化反应
B. 乙通入溴的四氯化碳溶液,最后得到无色溶液不能和液溴反应
C. 煤干馏得到的煤焦油可以分离出丙,丙是无色无味的液态烃
D. 丁发生催化氧化得到的产物不能与金属钠反应
【答案】A
【解析】根据原子成键特点知,碳原子能形成4个共价键、H原子能形成1个共价键、O原子能形成2个共价键,根据分子比例模型及原子成键特点知,甲、乙、丙、丁分别是甲烷、乙烯、苯和乙醇;A.甲烷性质较稳定,不易被一般的强氧化剂氧化,但能在氧气中燃烧,发生氧化反应,故A正确;B.碳碳不饱和键能和溴发生加成反应,乙烯中含有碳碳双键,所以能和溴发生加成反应而使溴的四氯化碳溶液褪色,同时生成1,2-二溴乙烷,溶于CCl4,1,2-二溴乙烷在光照条件下能和液溴发生取代反应,故B错误;C.从煤焦油中可以获取苯,但苯有特殊的气味,故C错误;D.乙醇发生催化氧化得到的产物乙酸,有酸性,能与金属钠反应,故D错误;答案为A。
【题型】单选题
【结束】
23
【题目】某有机物A由C、H、O三种元素组成,相对分子质量为90。将9.0gA完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g。A能与NaHCO3溶液发生反应,且2分子A之间脱水可生成六元环化合物。有关A的说法正确的是( )
A. 分子式是C3H8O3
B. A催化氧化的产物能发生银镜反应
C. 0.1molA与足量Na反应产生2.24L H2(标准状况)
D. A在一定条件下发生缩聚反应的产物是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语回答下列问题:
(1)写出二氧化碳分子的电子式:_____________。
(2)写出氮气分子的结构式_____________。
(3)①CaBr2②H2O③NH4Cl④H2O2⑤HClO⑥I2,只含有离子键的是(用序号回答,下同)_____________,含有共价键的离子化合物是_____________,含有非极性共价键的共价化合物是_____________,常温时为固体,当其熔化时,不破坏化学键的是_____________。
(4)在①![]() Li、②
Li、②![]() N、③
N、③![]() Li、④
Li、④![]() C几种核素中:
C几种核素中:
①_____________和_____________(填序号,下同)互为同位素。
②_____________和_____________的质量数相等,但不能互称同位素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列编号代表元素周期表中的一部分元素,用化学式或元素符号回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | ⑥ | ⑩ | ||||||
三 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
四 | ② | ④ | ⑧ |
(1)①、③、⑤的最高价氧化物的水化物碱性最强的是_______(填化学式,下同)。
(2)②、③、④形成的简单阳离子半径由大到小的顺序是______________。
(3)①和⑧的最高价氧化物对应的水化物化学式为________和________。①和⑧两元素形成的化合物的化学式为________,该化合物的溶液与元素⑦的单质反应的离子方程式为_______________________。
(4)⑦、⑧、⑩三种元素形成的气态氢化物最稳定的是________(填化学式,下同),三种元素非金属性由强到弱的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
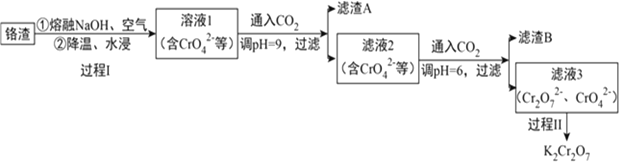
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是_______。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质可以循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
Cr2O72-+H2O K=4.0×1014滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。下表是不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 373 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:向滤液③中加入稀盐酸和KCl固体后,_____________,过滤,得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究小组用粗铜(含杂质Fe) 为原料制备CuCl2·2H2O晶体,再用CuCl2·2H2O晶体制备CuCl。
(1)制备CuCl2·2H2O晶体:
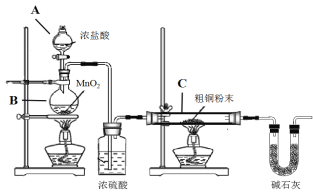
① B装置中发生反应的化学方程式是_________________
② 装置C中粗铜粉末(含杂质Fe)与气体充分反应时的生成物是______________
③ 反应完成后,将C中的固体用稀盐酸完全溶解,再调节pH值除杂,经一系列操作便可获得CuCl2·2H2O晶体。溶解C中生成物固体时,有时会加入少量双氧水,目的是__________
(2)制取CuCl,为了制取CuCl采用如图所示装置进行实验(夹持仪器略):

已知:![]()
④仪器X的名称是__________
⑤实验操作的先后顺序是a→__________________________→e(填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
⑥装置F中NaOH溶液的作用是___________________。
⑦ 反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质。请分析产生CuCl2杂质的原因是__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com