
【题目】室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中粒子的数目减小
B.再加入CH3COONa固体能促进醋酸的电离
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中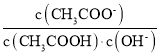 不变
不变
科目:高中化学 来源: 题型:
【题目】乙炔加氢是乙烯工业中的重要精制反应,利用这一反应可以将乙烯产品中的乙炔含量降低,以避免后续乙烯聚合催化剂的中毒,工业上称为碳二加氢过程。
已知:Ⅰ.CH![]() CH(g)+H2(g)→CH2=CH2(g) ΔH1 K1(400K)=4.2×1022
CH(g)+H2(g)→CH2=CH2(g) ΔH1 K1(400K)=4.2×1022
Ⅱ.CH![]() CH(g)+2H2(g)→CH3CH3(g) ΔH2=-311.4kJ·mol-1 K2(400K)=1.4×1038
CH(g)+2H2(g)→CH3CH3(g) ΔH2=-311.4kJ·mol-1 K2(400K)=1.4×1038
回答下列问题:
(1)已知几种化学键的键能如下表所示:
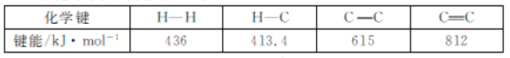
△H1=___kJmol-1。
(2)400K时,在密闭容器中将等物质的量的CH2=CH2(g)和H2(g)混合,采用适当的催化剂进行反应,生成CH3CH3(g),达到平衡时测得![]() =1016,则平衡时c(H2)=___molL-1。
=1016,则平衡时c(H2)=___molL-1。
(3)据前人研究发现乙炔在PV团簇表面催化加氢反应的部分历程如图1所示,其中吸附在PV表面上的物种用*标注。

推测乙烯在PV表面上的吸附为___(填“放热”或“吸热”)过程。图1历程中最大能金(活化能)E正=___kJ·mol-1,该步骤的化学方程式为___。
(4)T1℃时,将体积比为1:2的CH≡CH(g)和H2(g)充入刚性密闭容器中,加入催化剂发生反应Ⅱ,起始体系总压强为P0 kPa,实验测得H2的分压(p)与反应时间(t)的关系如图2所示。
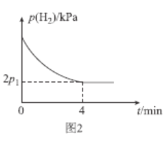
①T1℃时,0~4min内,平均反应速率v(HC≡CH)=___kPamin-1(用含p0、p1的代数式表示,下同)。
②T1℃时,该反应的化学平衡常数Kp=___kPa-2(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
③T1℃时,0~2min内p(H2)的减小量___(填“>”“<”或“=”)2~4min内p(H2)的减小量,理由为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 与 H2 合成(CH3)2O(二甲醚)是煤化工中的重要反应,有关信息如下:2CO2(g)+6H2(g) ![]() (CH3)2O(g)+3H2O(g) ΔH<0 恒容下,该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( ) (K 表示该反应的平衡常数)
(CH3)2O(g)+3H2O(g) ΔH<0 恒容下,该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( ) (K 表示该反应的平衡常数)
A.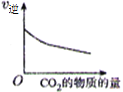 B.
B.
C.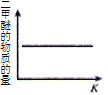 D.
D.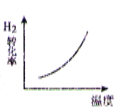
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的相对分子质量比乙的相对分子质量小B.甲的摩尔体积比乙的摩尔体积小
C.甲的分子数比乙的分子数少D.甲中所含的原子数比乙中的所含的原子数少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/LCuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K。
酸液都取足量、相同体积,请你帮助完成下面实验设计表(表中不留空格):
实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
① | 298 | 0.20mol/L |
| a.实验①和②是探究_____对锌与盐酸反应速率的影响; b.实验①和③是探究_____对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同 浓度的盐酸、醋酸与锌反应速率的区别 |
② | 308 | 0.20mol/L |
| |
③ | 298 | 0.40mol/L |
| |
④ | ______ |
| 0.20mol/L |
(2)若(1)中实验①锌片消失的时间是20s,则锌片剩余质量与时间关系图如下图:
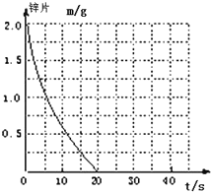
假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同、浓度相同时,醋酸的平均反应速度是盐酸的1/2.请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的锌片质量与时间关系曲线.____________________________
(3)某实验小组在做(1)中实验④时误加少量0.10mol/LCuCl2溶液,发现反应速率与(1)中实验①接近,加少量0.10mol/LCuCl2溶液后速率变快的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是主要大气污染物之一,工业上可用如下装置吸收转化SO2(A、B为惰性电极)。下列说法正确的是

A. 电子流动方向为:B→b→a→A
B. a、A极上均发生氧化反应
C. 离子交换膜为阳离子交换膜
D. B极上的电极反应式为:SO2+2eˉ+2H2O=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为摇摆电池![]() 的工作原理图,在充放电过程中,
的工作原理图,在充放电过程中,![]() 在两极之间“摇来摇去”,其总反应为:
在两极之间“摇来摇去”,其总反应为:![]() ,下列有关说法正确的是
,下列有关说法正确的是
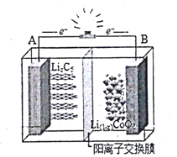
A.放电时,负极反应![]()
B.充电时,A极发生氧化反应
C.充电时,![]() 穿过隔离膜向B极移动
穿过隔离膜向B极移动
D.当B极失去xmol电子,电池消![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置的说法中正确的是( )

A. 装置①中,盐桥中的Cl- 移向H2SO4溶液
B. 装置②工作一段时间后,可加适量的Cu(OH)2恢复原溶液(原CuSO4溶液足量)
C. 装置①②中的溶液内的H+都在铜电极上被还原,有气泡产生
D. 装置②工作一段时间后,b极附近溶液的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中橙红色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O![]() 2CrO42—+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
2CrO42—+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
(1)向上述溶液中加入浓硫酸溶液,溶液呈_________色,因为_____________。
(2)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向__________方向移动(正或逆),溶液颜色将__________(加深或变浅)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com