
【题目】如图所示物质相互转换关系:

试回答:
(1)写出B的化学式____________、C溶液是______________。
(2)写出由E转变成F发生反应的化学方程式_______________。
(3)鉴别G溶液中阳离子的操作方法及实验现象:__________________。
(4)向G溶液中加入A的离子方程式____________________。
(5)写出D溶液中加入AgNO3得到白色沉淀的离子方程式__________________。
【答案】FeCl2 KOH 4Fe(OH)2+2H2O+O2=4Fe(OH)3 取G溶液少许与试管中,滴加KSCN若变红则阳离子是Fe3+ 2Fe3++Fe=3Fe2+ Ag++Cl-=AgCl↓
【解析】
D与硝酸银、稀硝酸反应得到的溶液,进行焰色反应显紫色,说明D溶液中含有K元素,D能和硝酸银溶液反应生成白色沉淀H,H为AgCl,所以D为KCl;白色沉淀E在空气中转化为红褐色沉淀F,则E为Fe(OH)2、F为Fe(OH)3;氢氧化铁被盐酸溶解生成溶液G,G为FeCl3;B和C反应生成氯化钾和氢氧化亚铁,所以B、C分别是氢氧化钾、氯化亚铁中的一种,G能和A反应生成B,所以A是Fe,则B是FeCl2,C是KOH,Fe与盐酸反应得到氯化亚铁与氢气,据此分析解答。
根据上述分析,A是Fe,B是FeCl2,C是KOH,D是KCl,E为Fe(OH)2,F为Fe(OH)3,G为FeCl3,H为AgCl,I为KNO3。
(1)B为FeCl2,C为KOH,故答案为:FeCl2;KOH;
(2)氢氧化亚铁被空气中的氧气氧化生成氢氧化铁的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)G为FeCl3溶液,鉴别G溶液中阳离子Fe3+的方法较多,主要有:①加碱有红褐色沉淀生成;②加KSCN溶液后溶液呈红色;③加苯酚呈紫色。常用KSCN溶液鉴别Fe3+,方法是:取少许G溶液于试管中,滴加KSCN溶液,溶液呈红色即可鉴别含Fe3+,故答案为:取G溶液少许与试管中,滴加KSCN若变红则阳离子是Fe3+;
(4)向氯化铁溶液加入Fe的离子反应方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(5)KCl溶液与AgNO3溶液反应的离子方程式:Ag++Cl-=AgCl↓;故答案为:Ag++Cl-=AgCl↓。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
A. 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B. 28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C. 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
D. 常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是( )
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是( )
A. 若降温,该反应的平衡常数增小
B. 吸收y mol H2只需1 mol MHx
C. 容器内气体密度保持不变
D. 若向容器内通入少量氢气,则v(放氢)>v(吸氢)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3 固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是________酸(填“强”或“弱”)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式________________________。
实验2:测定Na2CS3溶液的浓度,按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
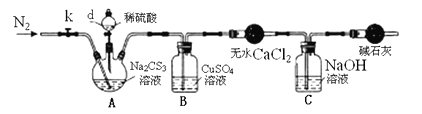
已知:Na2CS3 + H2SO4=Na2SO4 + CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放无水CaCl2的仪器的名称是____________。
(4)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是___________________。
(5)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为____________________。
(6)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究性学习小组拟用粗盐(含有少量杂质包括:泥沙、CaCl2、MgCl2、Na2SO4)经提纯后,配制0.4mol/L 450mL NaCl溶液.他们设计并实施了如下实验,请根据已学过的知识回答下列问题:
(1)取一定量的粗盐置于烧杯中加适量的水溶解。将配制的粗盐悬浊液过滤后取滤液加入过量的除杂试剂,如果除杂试剂可从下列六种溶液中选择①Na2CO3溶液②KOH溶液③AgNO3溶液④NaOH溶液⑤NaHCO3溶液⑥BaCl2溶液,则正确的试剂和加入的顺序应为:__________(填选项)
A.①②③ B.②⑥⑤ C.④⑥① D.①④⑥ E.⑥①④ F.⑥②⑤
(2)将所得的悬浊液经过滤后取滤液加入足量的盐酸,充分反应后对混合溶液进行蒸发、过滤、洗涤、干燥操作,得到纯净的NaCl固体,请描述在蒸发操作过程中玻璃棒的作用:_______________________________________________________
(3)利用(2)中所得的NaCl固体继续配制所需溶液.在托盘天平上称量____g NaCl固体.配制过程中需要使用的玻璃仪器有:烧杯、玻璃棒、_________
和_______________
(4)配制结束后同学们对实验中出现的某些错误操作,对最终配制的溶液浓度的影响进行了分析,则下列错误操作会导致最终配制溶液中NaCl的浓度相比0.4mol/L是偏小的是__________
A.在上述(2)步中没有使用盐酸处理滤液;
B.在上述(3)步中没有对烧杯和玻璃棒进行洗涤;
C.定容时俯视凹液面;
D.上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸,观察到的现象是__________________,通入过量二氧化碳的离子方程式是_________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
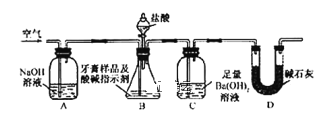
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:_____。
(4)C中反应生成沉淀的离子方程式是________。
(5)下列各项措施中,不能提高测定准确度的是___(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.0g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z 三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________。X与同周期卤族元素的第一电离能比较,较大的是____________________(填元素符号)。
(2)Y元素原子的价层电子的电子排布图为________,该元素的名称是__________。
(3)X与Z可形成化合物XZ3,XZ3分子的VSEPR模型为____________________。
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________________。
(5)XY43-的空间构型为__________,与其互为等电子体的一种分子__________。
(6)X的某氧化物的分子结构如图所示。

该化合物的化学式为___________,X原子采取___________杂化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式____________________。
(2)下列三种情况下,离子方程式与(1)相同的是_____(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度![]() 表示)可近似地用图中的_____曲线表示(填序号)。
表示)可近似地用图中的_____曲线表示(填序号)。
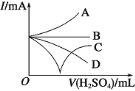
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将_____(选填“上浮”、“不动”、“下降”)。
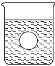
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com