
【题目】下列说法不正确的是
A. SiO2硬度大的原因与Si、O原子之间的成键方式及排列方式有关
B. 乙醇沸点高于二甲醚的原因与分子间作用力大小有关
C. 冰醋酸溶于水时只破坏分子间作用力
D. MgO熔点高达![]() 是因为其中的离子键较难被破坏
是因为其中的离子键较难被破坏
【答案】C
【解析】
A.SiO2硬度大是由于在晶体中Si、O原子之间形成共价键,每个Si用途4个O原子形成共价键,每个O原子与2个Si形成共价键,这种结构向空间扩展,就形成了立体网状结构,由于共价键是一种强烈的相互作用力,断裂消耗很多能量,因此熔沸点高,硬度大,A正确;
B.乙醇和二甲醚互为同分异构体,乙醇分子之间除存在范德华力外,还存在氢键,增加了分子之间的吸引力,而二甲醚分子之间只存在范德华力,所以乙醇的沸点高于二甲醚的原因与分子间作用力大小有关,B正确;
C.乙酸羟基上氢较活泼,在水中会电离出氢离子显弱酸性,所以共价键被破坏,C错误;
D.MgO晶体中所含离子半径小、电荷数多,晶格能大,MgO晶体的熔点高,D正确;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】合理利用资源,加强环境保护,降低碳排放,实施低碳经济是今后经济生活主流。回答下列问题:
(1)下列措施不利于有效减少二氧化碳的是_______(填字母)。
a.植树造林,保护森林,保护植被
b.加大对煤和石油的开采,并鼓励使用液化石油气
c.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发
d.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
(2)科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1:4的物质的量之比混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式:
CO2+4H2![]() _______+2H2O
_______+2H2O
(3)用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2 mol CO2和6 mol H2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),能判断该反应已达化学平衡的标志是____(填字母)。
CH3OH(g)+H2O(g),能判断该反应已达化学平衡的标志是____(填字母)。
a.CO2百分含量保持不变
b.容器中混合气体的质量保持不变
c.容器中H2浓度与CO2浓度之比为3:1
d.CO2的生成速率与CH3OH的生成速率相等
现测得CO2相CH3OH (g)的浓度随时间变化如图所示。
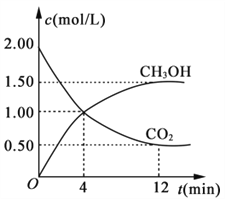
从反应开始到平衡,氢气的平均反应速率v(H2)=________。
(4)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2 CO3+6H2O。通入甲醇的电极为燃料电池的______(填“正”或“负”)极,正极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的合成路线如下图所示:
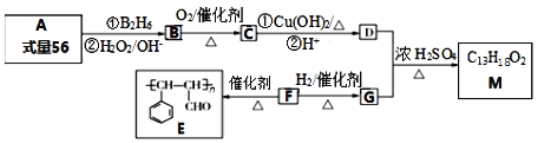
已知:(1)A是含一个支链的烃;
(2)R-CH=CH2 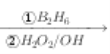 R-CH2CH2OH。
R-CH2CH2OH。
请回答下列问题:
(1)有机物A的系统命名为_______________。
(2)F中官能团的名称为:______________;F与新制的氢氧化铜悬浊液反应的化学方程式:________。
(3)D+G→ M的反应方程式为_____________。
(4)X是G的同系物,且相对分子质量比G小14,X有多种同分异构体。X中满足与FeCl3溶液反应显紫色,其核磁共振氢谱显示有4种不同化学环境的氢,且峰面积比为1:1:2:6的结构简式为_________。
(5)参照M的合成路线,设计一条由丙烯为起始原料制备丙酸丙酯的合成路线无机试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是![]()
![]()
A. CS2是V形分子 B. SnBr2键角大于![]()
C. BF3是三角锥形分子 D. NH4+键角等于10928ˊ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() 的叙述错误的是( )
的叙述错误的是( )
A. 原子序数116B. 中子数177
C. 核外电子数116D. 相对原子质量293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素的单质和化合物在化工、医药、材料等领域有着广泛的应用。
(1)锗是重要半导体材料,基态Ge原子中,核外电子占据最高能级的符号是______,该能级的电子云轮廓图为________。Ge的晶胞结构与金刚石类似,质地硬而脆,沸点2830℃,锗晶体属于_______晶体。
(2)(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为_______,(CH3)3C+中碳骨架的几何构型为________。
(3)治疗铅中毒可滴注依地酸钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_______。
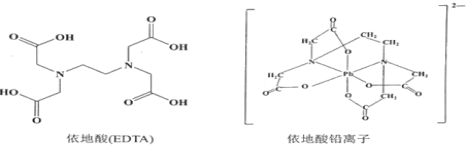
A.形成依地酸铅离子所需n(Pb2+)∶n(EDTA)=1∶4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(4)下表列出了碱土金属碳酸盐的热分解温度和阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
碱土金属碳酸盐同主族由上到下的热分解温度逐渐升高,原因是:__________。
(5)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图:
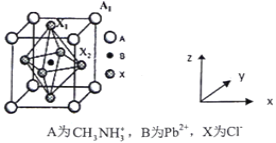
①若该晶胞的边长为anm,则Cl-间的最短距离是________。
②在该晶胞的另一种表达方式中,若图中Pb2+处于顶点位置,则Cl-处于____位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、锌及其化合物用途非常广泛。回答下列问题:
(1)O和S处于同一主族。H2O及H2S中,中心原子的杂化方式相同,键长及键角如图所示。
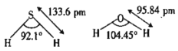
①H2O分子中的键长比H2S中的键长短,其原因是________。
②H2O分子中的键角∠HOH比H2S分子中的键角∠HSH大,其原因是________。
(2)单质硫与热的NaOH浓溶液反应的产物之一为Na2S3。S32-的空间构型为______,中心原子的杂化方式为_______。
(3)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中含有______个σ键。
②分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为________。
),则噻吩分子中的大π键应表示为________。
③噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,其原因是_________。
)的沸点在129~131℃之间,后者沸点较高,其原因是_________。
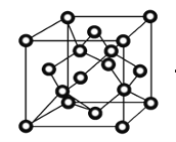
(4)冰晶体的结构与金刚石的结构相似,属立方晶系。如图,将金刚石晶胞中的C原子全部置换成O原子,O原子与最近距离的四个O原子相连,H原子插入两个相连的O原子之间,与氧形成一个共价键和一个氢键,即为冰中的共价键和氢键。0℃时冰晶体中氢键的键长(定义氢键的键长为O—H…O的长度)为_____cm(列出计算式即可)。(0℃时冰密度为0.9g/cm3。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
A. ①②B. ①③C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的反应往往伴随副反应发生,因此需要分离提纯。有一种水果香精的合成步骤如下:
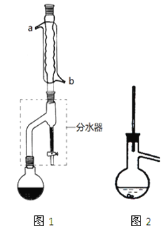
Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸(乙酸)和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好。在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min。
Ⅱ分离提纯:
①当分水器中的液面不再升高时,冷却,放出分水器中的水,把反应后的溶液与分水器中的酯层合并,转入分液漏斗中,用10mL10%碳酸钠溶液洗至酯层无酸性(pH=7),充分振荡后静置,分去水层。
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥(生成MgSO47H2O晶体)
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如下:
化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
制备过程中还可能与的副反应有2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
根据以上信息回答下列问题:
(1)写出合成乙酸正丁酯的化学方程式____________。
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从______(填a或b)管口通入。
(3)步骤①中碳酸钠溶液的作用主要是除去硫酸、_________、___________。
(4)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先___________(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有___________________杂质。
(5)步骤③的常压蒸馏,需控制一定的温度,你认为在_______中加热比较合适(请从下列选项中选择)。
A.水 B.甘油(沸点290℃) C.石蜡油(沸点200~300℃) D.沙子
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的转化率约为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com