
【题目】Ⅰ. 在容积为5L的密闭容器中,通入5 mol N2和8 mol H2,在一定条件下反应生成NH3,当反应进行到2 min时,测得容器内有4 mol NH3。则:
(1)2 min时,容器内n(N2)=________ ,c(H2)=___________。
(2)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为 _______。
Ⅱ.在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行
【答案】3 mol 0.4 mol/L 9:13 ![]() 吸热 BC 830 逆向
吸热 BC 830 逆向
【解析】
I.(1)根据三段式计算2min后时各组分的物质的量,根据c=![]() 计算H2的浓度;
计算H2的浓度;
(2)计算出反应前容器内气体的总物质的量是N2和H2的物质的量的和;2 min时,容器内气体的总物质的量为N2、H2、NH3物质的量之和,据此解答;
II.(1)平衡常数为化学反应达到平衡时各种生成物浓度幂之积与反应物浓度幂之积的比;
(2)根据温度升高,平衡常数变大来分析;
(3)利用平衡的特征“等”和“定”来分析;
(4)将物质浓度关系式变性,跟化学平衡常数比较,判断其反应的温度;
(5)将该条件下的物质浓度带入浓度商式子中,得到其数值,并与该温度下的化学平衡常数K进行比较,若Qc>K,化学平衡向逆反应方向移动,若Qc=K,处于平衡状态;若Qc<K,反应正向进行,由此分析解答。
I.(1) N2与H2反应产生NH3,方程式为N2+3H2![]() 2NH3,在反应开始时,n(N2)=5mol,n(H2)=8mol,n(NH3)=0mol,2min时,n(NH3)=4mol,根据物质转化关系可知反应消耗N22mol,消耗H26mol,则2min时各种气体的物质的量分别是n(N2)=(5-2)mol=3mol,n(H2)=(8-6)mol=2mol,n(NH3)=4mol,2min时,H2的浓度c=
2NH3,在反应开始时,n(N2)=5mol,n(H2)=8mol,n(NH3)=0mol,2min时,n(NH3)=4mol,根据物质转化关系可知反应消耗N22mol,消耗H26mol,则2min时各种气体的物质的量分别是n(N2)=(5-2)mol=3mol,n(H2)=(8-6)mol=2mol,n(NH3)=4mol,2min时,H2的浓度c=![]() =0.4mol/L;
=0.4mol/L;
(2)反应前容器内气体的总物质的量是N2和H2的物质的量的和,n(N2)+ n(H2)=5mol+8mol=13mol,2 min时,容器内气体的总物质的量为N2、H2、NH3物质的量之和,n= n(N2)+n(H2)+n(NH3)=3mol+2mol+4mol=9mol,所以2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为n(后):n(前)=9:13;
II. (1)平衡常数为化学反应达到平衡时各种生成物浓度幂之积与反应物浓度幂之积的比,则CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K=
CO(g)+H2O(g)的平衡常数K=![]() ;
;
(2)由表格数据可知:温度升高,化学平衡常数变大可知,升高温度,平衡向正反应方向移动,根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,所以该反应的正反应为吸热反应;
(3)A.该反应为气体的物质的量不变的反应,容器中气体压强始终不变,因此压强不变不能作为判定平衡的方法,A错误;
B.混合气体中c(CO)不变,说明反应达到化学平衡,B正确;
C.v正(H2)=v逆(H2O),则对于氢气来说正、逆反应速率相等,说明反应达到平衡,C正确;
D.c(CO2)=c(CO),该反应不一定达到平衡,浓度关系取决于反应物的起始量和转化率,D错误;
故合理选项是BC;
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),则![]() =1,而K=
=1,而K=![]() ,根据温度与化学平衡常数的关系可知:反应温度为800℃;
,根据温度与化学平衡常数的关系可知:反应温度为800℃;
(5)Qc=![]() =
=![]() =1>0.9=K,说明化学平衡向逆反应方向移动。
=1>0.9=K,说明化学平衡向逆反应方向移动。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】浓硫酸分别和三种钠盐反应,下列分析正确的是

A. 对比①和②可以说明还原性Br->Cl-
B. ①和③相比可说明氧化性Br2>SO2
C. ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D. ③中浓H2SO4被还原成SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Cu、Fe2O3的混合物中加入400 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A. 2.4 g B. 3.2 g C. 4.8 g D. 6.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
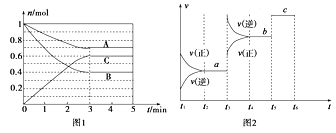
(1)该反应的化学方程式为____________________________。
(2)该反应的反应速率v随时间t的关系如上图2所示:
①根据上图判断,在t3时刻改变的外界条件是______________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
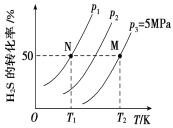
(1)△H_________ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为________________。
(3)图中M点的平衡常数Kp =_______MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类的生产、生活与化学息息相关,下列说法不正确的是![]()
![]()
A.将铝制品置于电解液中作为阳极,用电化学氧化的方法,可以在铝制品表面生成坚硬的氧化膜。
B.防治酸雨的措施可以对煤燃烧后形成的烟气脱硫,目前主要用石灰法。
C.压敏胶黏剂(即时贴)只需轻轻一压就能黏结牢固,其黏附力为分子间作用力。
D.人体所需六大营养物质:糖类、油脂、蛋白质、维生素、无机盐和水,其中产能最高的是糖类。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOH![]() H++CH3COO,下列叙述不正确的是
H++CH3COO,下列叙述不正确的是
A.升高温度,平衡正向移动,醋酸的电离常数Ka增大
B.0.10 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)增大。
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是深入实施“2025中国制造”年,而化学与人类的生产生活密切相关,下列有关说法错误的是![]()
![]()
A.3D打印中的石墨烯由离子构成,而金刚石由原子构成
B.“北斗组网卫星”所使用的碳纤维,是一种无机非金属材料
C.世界杯赞助商之一的蒙牛奶业,其生产的牛奶属于胶体,具有丁达尔效应
D.港珠澳大桥设计建造时采用了外接铝的牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验、实验现象和相应结论都正确的是
实验 | 现象 | 结论 | |
A | 向1mL | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com