
【题目】向HCl、NH4Cl、AlCl3溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)随加入NaOH溶液体积(V)的关系正确的是( )
A. 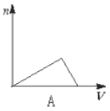 B.
B. 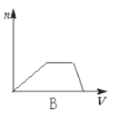
C. 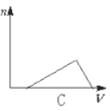 D.
D. 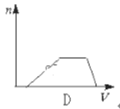
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,研究非金属元素性质变化规律。

已知:高锰酸钾在常温下与浓盐酸反应产生氯气。
(1)如果C中装饱和的H2S溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,证明氯的非金属性比硫的非金属性 ______ (填“强”或“弱”或“无法判断”)。
(2)利用如图装置证明Cl2氧化性强于I2的氧化性,则A中装浓盐酸,B中装入高锰酸钾粉末,C中装入淀粉KI溶液,则C中现象是 ______
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:非金属性:N>C>Si,C中装试剂 ______ ,实验现象为 ______ 该装置存在不足之处,改进措施为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取有机物A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。A分子的质谱图如下图所示:
| (1)有机物A的摩尔质量为______。 |
(2)将此9.0g A在足量纯O2充分燃烧,并使 其产物依次通过无水氯化钙、无水硫酸铜、碱石灰。实验后硫酸铜粉末没有变蓝,称量无水氯化钙增重5.4g,碱石灰增重13.2g。 | (2)经计算,有机物A的分子式为_______。 |
(3)经红外光谱测定,证实其中含有-OH和-COOH两种官能团;经核磁共振氢谱的测定,其核磁共振氢谱图如下图:
| (3)A的结构简式____________________。 |
(4)经红外光谱测定,A的一种同分异构体B中,含有与A相同的官能团。 | (4)A的同分异构体B的结构简式为:____。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
B. 25 ℃、101 kPa时,1 mol S和2 mol S的燃烧热不相等
C. 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学 键时放出的能量 | 436 kJ·mol-1 | 243 kJ·mol-1 | 431 kJ·mol-1 |
则1/2H2(g)+ 1/2Cl2(g)![]() HCl(g) ΔH=-183 kJ·mol-1
HCl(g) ΔH=-183 kJ·mol-1
D. 任何化学反应都伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属粉末的混合物15 g,投入足量的稀盐酸中,得到5.6 L氢气(标准状况),则这种混合物可能是
A. 镁和铁 B. 镁和铝 C. 铁和锌 D. 铜和锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、B等元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅的制造;由第二周期元素组成的与BCl3互为等电子体的阴离子为_______(填离子符号,填一个)。
(2)氨硼烷(H3N→BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料.
①H3N→BH3中B原子的外围电子排布图_________。
②Ti(BH4)3由TiCl3和LiBH4反应制得,写出该制备反应的化学方程式____;基态Ti3+的成对电子有___对,BH4-的立体构型是____;Ti(BH4)3所含化学键的类型有____;
③氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3;与上述化学方程式有关的叙述不正确的是 _____________
A.氨硼烷中存在配位键
B.第一电离能:N>O>C>B
C.反应前后碳原子的轨道杂化类型不变
D.CH4、H2O、CO2都是非极性分子
(3)磷化硼(BP)是受到高度关注的耐磨材料,如图1为磷化硼晶胞;
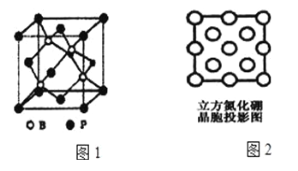
①晶体中P原子填在B原子所围成的____空隙中。
②晶体中B原子周围最近且相等的B原子有____个。
(4)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________。图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置______。其中“●”代表B原子,“×”代表N原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在氧气里充分燃烧,生成的CO2和H2O的物质的量之比为1∶1,由此可以得出该有机物( )
A.分子中肯定只含C、H两种元素
B.分子中C和H的个数比为1∶2
C.分子中肯定含有氧原子
D.分子中C、H、O的个数比为1∶2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com