
【题目】1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A.Na2CO3 B.Na2O2 、Na2CO3 C.NaOH 、Na2CO3 D.Na2O2 、NaOH 、Na2CO3
科目:高中化学 来源: 题型:
【题目】A~F六种元素中,除F外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 其形成的一种同位素原子在考古中可推测化石的年代 |
B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
C | 地壳中含量最多的元素 |
D | D原子的内层电子数是最外层电子数的5倍 |
E | 其单质主要存在于火山口附近 |
F | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
请回答下列问题:
(1)A在元素周期表中的位置是____________;A与C形成的化合物AC2的电子式是__________。
(2)下列事实能证明C和E的非金属性强弱的是 。(填序号)
①常温下,C的单质呈气态,E的单质呈固态
②C的气态氢化物的稳定性强于E的气态氢化物的稳定性
③C与E形成的化合物中,E呈正价
④E的氢化物的沸点高于C的氢化物的沸点
(3) 由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是 (填化学式),它与足量NaOH溶液在加热时反应的离子方程为: 。
(4) FC与足量B的最高价氧化物的水化物的稀溶液反应的离子方程式 。若有标准状况下5.6L的BC生成,则转移的电子数为 。
(5) A的氢化物有多种,1 mol A的某种氢化物分子中含有14 mol电子,已知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40 kJ,写出表示该氢化物燃烧热的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种新型药物,具有血管扩张活性的选择性β1肾上腺素受体拮抗剂,用于合成该药物的中间体G的部分流程如下:
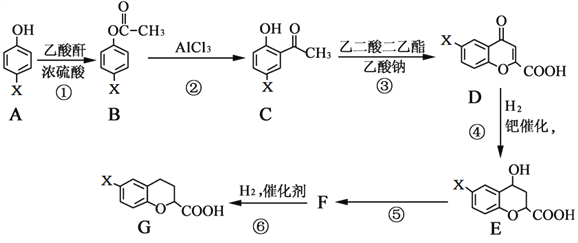
已知:乙酸酐的结构简式为:![]()
请回答下列问题:
(1)G物质中的含氧官能团的名称是________、________。
(2)反应A→B的化学方程式为_________________________________________。
(3)上述④、⑤变化过程的反应类型分别是_______________、______________。
(4)有机物F的结构简式为______________________。
(5)写出满足下列条件的C的同分异构体的结构简式:___________、___________。
Ⅰ. 苯环上只有两种取代基。
Ⅱ. 分子中只有4种不同化学环境的氢。
Ⅲ. 能与NaHCO3反应生成CO2。
(6)根据已有知识并结合相关信息,补充完成以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备![]() 的合成路线流程图(无机试剂任选)。部分合成路线流程图如下:
的合成路线流程图(无机试剂任选)。部分合成路线流程图如下:

请完成合成路线_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡是一种强介电化合物材料,具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”,工业制取方法如下,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧后可获得钛酸钡粉体。

(1)酸浸时发生的反应的离子方程式为__________________;
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_________________________;
(3)加入H2C2O4溶液时,发生反应的化学方程式为____________________;可循环使用的物质X是________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_______________________;
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气体产物有CO、_______和_________;
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.58×10-9,请问至少需要______ mol·L-1的碳酸钠溶液浸泡才能实现上述转化(忽略CO32-的水解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M被广泛用于医药、香料的合成,其一种合成路线如下(反应试剂与反应条件已省略):

已知A与B互为同分异构体。完成下列填空:
(1)写出M中含氧官能团的名称:__________。1mol D最多能与___________mol ![]() 发生加成反应。
发生加成反应。
(2)反应②所需试剂与条件是______________。反应③的反应类型是__________________。
(3)写出结构简式。A ___________________C _______________________
(4)写出检验D已完全转化为M的方法。___________________。
(5)写出两种符合下列要求的M的同分异构体的结构简式。 _____________
i. 苯环上的一氯代物只有两种 ii. 能发生水解反应 iii. 分子中含有两个甲基
(6)有人认为仅用反应①就能得到B,但事实证明产物中B的含量远远小于A,由此可以得到的结论是:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼( N2H4)是一种高能燃料,在工业生产中用途广泛。
(1)0.5mol肼中含有__________ mol极性共价键。
(2) 肼的性质与氨气相似,易溶于水,有如下反应过程:
N2H4+H2O![]() N2H4·H2O
N2H4·H2O![]() N2H5++OH-
N2H5++OH-
①常温下,某浓度N2H5C1溶液的pH为5,则该溶液中由水电离产生的c(H+)为______mol/L。
②常温下,0.2mol/L N3H4溶液0.1mol/L HCL溶液等体积混合,混合溶液的pH>7,
则溶液中v(N2H5+)________v(N2H4·H2O)(填“>”、“<”或“=”)。
(3)工业上可用肼(N2H4)与新制Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为______________________________________。
(4)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应成氮气与水蒸气。已知1.6g液态肼在上述反应中放出64.22kJ的热量,写出该反应的热化学方程式___________________。
(5)肼-双氧水燃料电池由于其较高的能量密度而广受关注,其工作原理如图所示。则电池正极反应式为_______________,电池工作过程中,A极区溶液的pH____________(填“增大”“减小”或“不变”)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向盛有50 mL pH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是

A. a→b的过程中,溶液中c(A-)与c(HA)之和始终不变
B. c点表示酸碱恰好完全反应
C. 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+)
D. 25 ℃时,HA的电离平衡常数Ka约为1.43×10-3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com