
| A、氢氧化钡溶液与硫酸反应 |
| B、氢氧化铜与稀硝酸反应 |
| C、氢氧化钾与稀盐酸反应 |
| D、氢氧化钠与醋酸溶液反应 |


科目:高中化学 来源: 题型:
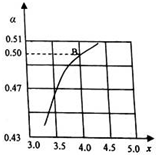 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种.请回答下列问题:| n(NH3) |
| n(CO2) |
| 两性氢氧化物 | Al(OH)3 | Ga(OH)3 |
| 酸式电离常数Kia | 2 10-11 | 1×10-7 |
| 碱式电离常数Kib | 1.3 10-33 | 1.4 10-34 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若X、Y、W形成的化合物为XYW2,则其水溶液可以显碱性 |
| B、Y的最高价氧化物对应的水化物一定是碱 |
| C、稳定性:W的氢化物>Z的氢化物,沸点:Z的氢化物>W的氢化物 |
| D、X、Y的氧化物晶体类型一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海水提取物质不一定都必须通过化学反应才能实现 |
| B、大量的氮、磷废水排入海洋,易引发赤潮 |
| C、为了防止中秋月饼等富脂食品氧化变质,延长食品保质期,在包装袋中常放入生石灰 |
| D、保护加酶洗衣粉的洗涤效果,应用温水溶解洗衣粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤、石油、天然气均为化石能源 |
| B、化石能源是可再生能源 |
| C、直接燃烧煤不如将煤进行深加工后再燃烧效果好 |
| D、化石燃料在燃烧过程中能产生污染环境的SO2等有害气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
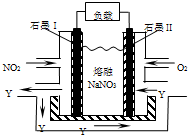 NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧化物Y,下列说法不正确的是( )
NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧化物Y,下列说法不正确的是( )| A、石墨I附近发生的反应为NO2+NO3--e-═N2O5 |
| B、石墨Ⅱ附近反生的反应为O2-4e-═2O2- |
| C、该电池放电时NO3-从右侧向左侧迁移 |
| D、相同条件下,放电过程中消耗的NO2和O2的体积比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,在20mL 0.1mol/L NaOH溶液中加入0.2mol/L CH3COOH溶液,所加入溶液的体积(v)和混合液中pH变化关系的曲线如图所示,若B点的横坐标a=10,下列分析的结论正确的是( )
25℃时,在20mL 0.1mol/L NaOH溶液中加入0.2mol/L CH3COOH溶液,所加入溶液的体积(v)和混合液中pH变化关系的曲线如图所示,若B点的横坐标a=10,下列分析的结论正确的是( )| A、在B点有:c(Na+)=c(CH3COO-) |
| B、对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C、C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
| D、D点时,c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
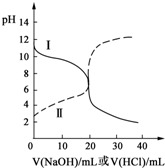 25℃时,取浓度均为0.1000mol?L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol?L-1NaOH溶液、0.1000mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1000mol?L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol?L-1NaOH溶液、0.1000mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )| A、根据滴定曲线可得,25℃时 Ka(CH3COOH)≈Kb(NH3?H2O)≈10-5 |
| B、当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交 |
| C、曲线Ⅱ:滴加溶液到10.00 mL时,溶液中c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
| D、在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com