
【题目】能一次区分乙醇、乙酸、苯和四氯化碳四种物质的试剂是
A.水
B.氢氧化钠溶液
C.盐酸
D.石蕊试液
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

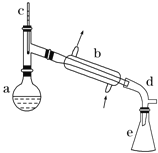
可能用到的有关数据如下:
相对分子质量 | 密度/(g/cm3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓H2SO4 。b中通入冷却水后,开始缓慢加热a,控制馏出物温度不超过90℃。
分离提纯:
反应粗产物倒入分流漏斗中,分别利用少量5%碳酸钠溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得纯净环己烯10g。
回答下列问题:
(1)装置b的名称是_____。
(2)加入碎瓷片的作用是_____,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_______(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生副产物的结构简式为_______。
(4)分液漏斗在使用前须清洗干净并________,在实验分离过程中产物应该从分液漏斗的________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是_____。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验中所得的环己烯的产率是________ (填正确答案的标号)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列A、B两组物质:
A组:CH3—CHCl—CH3、![]() 、HCOOH、CH3COOC2H5 。
、HCOOH、CH3COOC2H5 。
B组:CH3CH2CH2OH、银氨溶液、KOH溶液、Na2CO3溶液。 试回答:
①A组中_____________能跟B组中所有物质都可发生反应。
②B组中______________可跟A组中三种物质反应。
(2)苯的熔点为5.5℃,沸点为80.1℃,在寒冷的冬天怎样从细口的试剂瓶中取出苯___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可通过煤的液化合成甲醇,主反应为:CO(g)+2H2(g)=CH3OH(l) △H=x
(1)己知常温下CH3OH、H2和CO的燃烧热分別为726.5kl/mo1、285.5kJ/mol、283.0kJ/mol,則x=_______;为提高合成甲醇反应的选择性,关键因素是___________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应(CH3OH为气体),相关数据如图。

①该反应0-10min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是______(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为_______。相同条件下,若起始投料加倍,达平衡时,CO的体积分数将________(填“增大”、“减小”或“不变”)
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)表示平衡常数(以Kp表示),其中,PB=P总×B的体积分数;若在TK下平衡气体总压强xatm,则该反应Kp=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K的自然对数)如图,请分析lnK随T呈现上述变化趋势的原因是:____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“乙醇催化氧化”的实验装置如图所示:
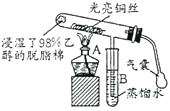
实验操作为:预先使棉花团浸透乙醇,并照图安装好仪器,在铜丝的中间部位加热片刻后,用气囊有节奏地鼓入空气,即可观察到以下明显的实验现象。
请回答以下问题:
(1)在实验过程中铜丝出现红色和黑色交替的现象,说明在该实验过程中催化剂_________![]() 填“参与了”或“没有参与”
填“参与了”或“没有参与”![]() 化学反应;写出乙醇催化氧化反应的化学方程式_________。
化学反应;写出乙醇催化氧化反应的化学方程式_________。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是____反应。
(3)B中用蒸馏水收集到的物质可能有__________![]() 填物质的名称
填物质的名称![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
A. 1B. 2C. 3D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。

(1)打开K2,合并K1。B为________极,A的电极反应为________________________。最终可观察到的现象是___________________________________________。
涉及的化学反应方程式有_______________________________。
(2)打开K1,合并K2。E为________极,F极的电极反应为_____,检验F极产生气体的方法是____________________________。
(3)若往U形管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是________,原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子共存的是
A.NO3-、Cl-B.CO32-、Cl-C.NO3-、SO42-D.OH-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com