
【题目】N2O5在一定温度下可发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据为:
4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据为:
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol/ L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是
A.500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
【答案】C
【解析】本题考查了化学平衡状态判断、化学平衡有关计算、化学平衡影响因素、平衡常数的相关知识。A.依据图标数据分析计算500 s内N2O5(g)消耗的浓度=5.00 mol/L3.52 mol/L=1.48 mol/L,分解速率=![]() =2.96×103 mol/(Ls),故A正确;B.由表中数据可知,T1温度下,1000 s时反应到达平衡,平衡时c(N2O5)=2.5 mol/L,c(NO2)=5 mol/L,c(O2)=1.25 mol/L,平衡常数K =
=2.96×103 mol/(Ls),故A正确;B.由表中数据可知,T1温度下,1000 s时反应到达平衡,平衡时c(N2O5)=2.5 mol/L,c(NO2)=5 mol/L,c(O2)=1.25 mol/L,平衡常数K =![]() =
=![]() = 125,转化率为
= 125,转化率为![]() ×100%=50%,故B正确;C.该反应正反应是吸热反应,升高温度,反应速率加快,平衡向正反应移动,平衡时N2O5(g)浓度应降低,其他条件不变时,T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol/L,浓度大于2.5 mol/L,故不可能为升高温度,应为降低温度,故T1>T2,故C错误;D.平衡常数只受温度影响,T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,反应是吸热反应,则T1>T3,故D正确;故选C。
×100%=50%,故B正确;C.该反应正反应是吸热反应,升高温度,反应速率加快,平衡向正反应移动,平衡时N2O5(g)浓度应降低,其他条件不变时,T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol/L,浓度大于2.5 mol/L,故不可能为升高温度,应为降低温度,故T1>T2,故C错误;D.平衡常数只受温度影响,T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,反应是吸热反应,则T1>T3,故D正确;故选C。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】下列关于碱金属的原子结构和性质的叙述不正确的是
A. 碱金属元素的原子在化学反应中容易失去电子
B. 碱金属单质都是强还原剂
C. 碱金属单质都能在O2中燃烧生成过氧化物
D. 碱金属单质都能与水反应生成碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
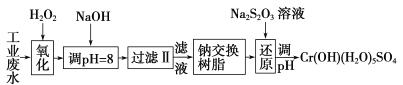
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗172.8g Cr2O72-转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-==Fe2+,阴极反应式是2H++2e-==H2↑。
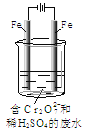
(1)电解时能否用Cu电极来代替阳极上的Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因_________________。
(4)若溶液中初始含有0.1mol Cr2O72-,则生成的阳离子全部转化化成沉淀的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2是人类赖以生存的物质,O2的摩尔质量为( )
A. 16 g·mol-1 B. 32 g·mol-1
C. 64 g·mol-1 D. 10 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的
A.甲烷的燃烧热为890 kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)![]() CO2(g)+ 2H2O(g) △H=890 kJ/mol
CO2(g)+ 2H2O(g) △H=890 kJ/mol
B.在一定条件下将1 mol SO2和0.5 mol O2置于密闭容器中充分反应,放出热量79.2 kJ,则反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H=158.4 kJ·mol1
2SO3(g) △H=158.4 kJ·mol1
C.中和反应热为57.3 kJ·mol1 NaOH(s)+![]() H2SO4(aq)
H2SO4(aq)![]()
![]() Na2SO4(aq)+H2O(l) △H=57.3 kJ·mol1
Na2SO4(aq)+H2O(l) △H=57.3 kJ·mol1
D.2.00 g C2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6 kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) △H=2589.6 kJ·mol1
4CO2(g)+2H2O(l) △H=2589.6 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体.CO2与化合物Ⅰ反应生成化合物Ⅱ,如反应所示(其他试剂、产物及反应条件均省略).
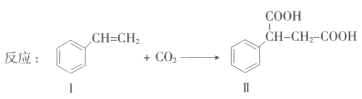
(1)化合物Ⅰ的官能团名称为___________,分子式为______,1 mol该物质完全燃烧需消耗_______mol O2 .
(2)写出化合物Ⅰ在一定条件下的加聚反应方程式___________。(不需要注明反应条件).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 淀粉、纤维素等高分子化合物均属于纯净物
B. 非金属氧化物都是酸性氧化物
C. 食醋、纯碱、食盐分别属于酸、碱、盐
D. 丁达尔效应可用于区别溶液与胶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com