
【题目】O2是人类赖以生存的物质,O2的摩尔质量为( )
A. 16 g·mol-1 B. 32 g·mol-1
C. 64 g·mol-1 D. 10 g·mol-1
科目:高中化学 来源: 题型:
【题目】某溶液中,只含有下表中所示的四种离子(忽略水的电离),则X离子及其个数b可能为

A.NO3-、4a B.OH-、8a C.SO42-、4a D.SO42-、8a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同)。右侧CO与CO2分子数之比为________________;
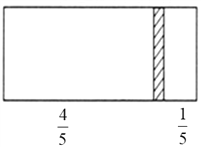
(2)已知质量分数为28%的氨水物质的量浓度为12 mol·L-l,则质量分数为14%的氨水物质的量浓度_____(填“大于”、“小于”或“等于”) 6 mol·L-l;已知4 mol·L-l 的硫酸溶液密度为![]() ,2 mol·L-l 的硫酸溶液密度为
,2 mol·L-l 的硫酸溶液密度为![]() 。100g浓度为4mol·L-l 的硫酸溶液与________mL水混合,使硫酸的物质的量浓度减小到2 mol·L-l 。(用含
。100g浓度为4mol·L-l 的硫酸溶液与________mL水混合,使硫酸的物质的量浓度减小到2 mol·L-l 。(用含![]() 、
、![]() 的式子表示)
的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池反应的离子方程式为Fe+2H+=Fe2++H2↑,则下列说法正确的是
A. 硝酸可能为电解质溶液
B. 锌可能为原电池正极
C. 铁的质量不变
D. 铜可能为原电池正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5在一定温度下可发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据为:
4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据为:
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol/ L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是
A.500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓硫酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓硫酸的物质的量浓度为___________________。
(2)用此浓硫酸配制 240mL 1.0 mol·L-l 稀硫酸所需浓硫酸的体积是____________,量取浓硫酸所用的量筒的规格是_________(从下列量筒的规格中选用)
A.10mL B.20mL C.50mL D.100mL
(3)稀释浓硫酸的操作为_________________________________________________;
(4)容量瓶上标有以下五项中的______________;
A.温度 B.浓度 C.规格 D.压强 E.刻度线
(5)配制过程中,下列操作会引起结果偏高的是_______(填序号);
① 未洗涤烧杯、玻璃棒 ② 量取浓硫酸时仰视 ③ 定容时俯视刻度线
④ 容量瓶不干燥,含有少量蒸馏水 ⑤ 溶液未冷却至室温就转移到容量瓶
(6)100 mL 1.0 mol·L-l 稀硫酸与300 mL 1.0 mol·L-l BaCl2溶液混合,所得溶液中H+的物质的量浓度为_______________ (忽略混合时溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列叙述正确的是( )
A. 3.4g –OH(羟基)中含有的质子数为2NA
B. 标准状况下,22.4L CH3CH2OH中含有的C-H键数目是5NA
C. KClO3+ 6HCl(浓)== KCl + 3Cl2↑+ 3H2O,1mol氧化剂参与反应转移电子数为5NA
D. 0.1 L 0.5 mol/L CH3COOH溶液中含有的H+数为0.05NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com