
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.己知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-
H++A2-
(1)某温度下,若向0.1mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是__________。
A.c(H+)·c(OH-)=l.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05mol·L-1
(2)己知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2+(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有____________。
Ca2+(aq)+A2+(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有____________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
(1)该废水中加入绿矾和H+,发生反应的离子方程式为________________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
【答案】 BC BD Cr2O72-+6Fe2+ +14H+=2Cr3++6Fe3++7H2O 3.0×10-6mol·L-1
【解析】Ⅰ.(1)A、水的离子积常数与温度有关,温度越高,水的离子积常数越大,温度未知,所以水的离子积常数也未知,故A错误;B、溶液呈电中性,氢离子浓度等于氢氧根离子浓度,溶液中阴阳离子所带电荷相等,所以c(Na+)+c(K+)=c(HA-)+2c(A2-),故B正确;C、H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-,NaHA溶液中HA-只电离,不水解,溶液呈酸性,Na2A溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的物质的量应大于氢氧化钾的物质的量,所以同一混合溶液中c(Na+)>c(K+),故C正确;D、NaHA溶液呈酸性,Na2A溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的体积应大于氢氧化钾的体积,所以c(Na+)+c(K+)>0.05mol/L,故D错误;故答案为:BC;
H++A2-,NaHA溶液中HA-只电离,不水解,溶液呈酸性,Na2A溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的物质的量应大于氢氧化钾的物质的量,所以同一混合溶液中c(Na+)>c(K+),故C正确;D、NaHA溶液呈酸性,Na2A溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的体积应大于氢氧化钾的体积,所以c(Na+)+c(K+)>0.05mol/L,故D错误;故答案为:BC;
(2)CaA(s)![]() Ca2+(aq)+A2-(aq)△H>0,降温平衡,逆向移动,c(Ca2+)减小,加入NH4Cl晶体,铵根离子与A离子水解相互促进,钙离子浓度增大,加入Na2A固体.A-离子浓度增大,平衡逆向移动,c(Ca2+)减小,故答案为:BD。
Ca2+(aq)+A2-(aq)△H>0,降温平衡,逆向移动,c(Ca2+)减小,加入NH4Cl晶体,铵根离子与A离子水解相互促进,钙离子浓度增大,加入Na2A固体.A-离子浓度增大,平衡逆向移动,c(Ca2+)减小,故答案为:BD。
Ⅱ.(1)酸性条件下,Cr2O72-具有强氧化性,可氧化Fe2+,反应的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;
(2)若处理后的废水中残留的c(Fe3+)=2×10-13molL-1,Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=4.0×10-38,计算得到c3(OH-)=2×10-25mol/L,则残留的Cr3+的浓度为Ksp[Cr(OH)3]=c(Cr3+)c3(OH-) =6.0×10-31 ,c(Cr3+)=3×10-6molL-1;故答案为:3×10-6molL-1。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.化学实验室中的蔗糖纯度很高,可以用来食用
B.实验室中制取完有毒气体,开窗通风即可
C.实验室中用过的废洗液,可以用来冲洗厕所
D.不能用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应A(g)+3B(g)2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )
A.vA=vB
B.vA=2vC
C.3vB=vC
D.vB=3vD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2 , 实验装置如图所示. 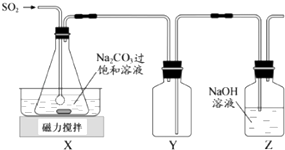
当溶液pH约为4时,停止反应.在20℃左右静置结晶.生成Na2S2O5的化学方程式为:2NaHSO3═Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2 , 其离子方程式为 .
(2)装置Y的作用是
(3)析出固体的反应液经减压抽滤、洗涤、25℃﹣30℃干燥,可获得Na2S2O5固体.
①组成减压抽滤装置的主要仪器是布氏漏斗、和抽气泵.
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体.用饱和SO2水溶液洗涤的目的是 .
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4 , 其可能的原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行过滤操作时应选用的一组仪器及用品是
A.玻璃棒、滤纸、烧瓶、漏斗、铁架台
B.滤纸、烧杯、试管夹、漏斗、玻璃棒
C.漏斗、玻璃棒、烧杯、铁架台、滤纸
D.烧杯、酒精灯、试管、铁架台、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上操作步骤中有一步有错误,请指出编号 ,该错误操作会导
致测定结果 (填“偏大”、“偏小”或“无影响”)
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 中。(从右图中选填“甲”或“乙”)

(3)下列操作会引起实验结果偏大的是: (填编号)
A.在锥形瓶装液前,留有少量蒸馏水 |
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡 |
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗 |
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外 |
(4)判断到达滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟之内不再改变。
(5)以下是实验数据记录表

通过计算可得,该盐酸浓度为: mol·L-1(计算结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是一种治疗关节炎止痛药,合成F的一种传统法路线如图: 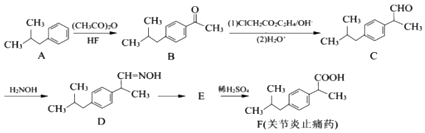
已知:① ![]() ;②
;② ![]() ; ③
; ③ ![]() .
.
(1)B中含氧官能团的名称为 .
(2)已知D经过反应可生成E,E的分子式C13H17N,写出E的结构简式 .
(3)A→B的反应类型为、A→B的反应方程式为 .
(4)写出同时满足下列条件的F的一种同分异构体的结构简式:(写一种).
①能发生银镜反应;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;③分子中只有4种不同化学环境的氢.
(5)合成F( ![]() )的一种改良法是以2﹣甲基﹣1﹣丙醇(
)的一种改良法是以2﹣甲基﹣1﹣丙醇( ![]() )、苯、
)、苯、
乙酸酐[(CH3CO)2O]为原料来合成,写出有关F的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
H2C=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH .
CH3CH2OH .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有下列性质的有机化合物中同分异构体数目最多的是(不考虑立体异构)( )
选项 | A | B | C | D |
分子式 | C4H8Cl2 | C5H10O2 | C4H8O2 | C9H12 |
类别 | 含氯化合物 | 羧酸 | 酯 | 含有苯环的烃 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com