
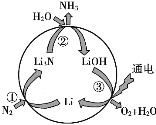
【题目】“氮的固定”对保障人类生存具有重大意义。一种新型合成氨的原理如图所示:
(1)N2的电子式:_____。
(2)Li3N中含有的化学键类型是_____。
(3)热稳定性:NH3_____H2O(填“>”或“<”)。
(4)NH3 、H2O分子中化学键极性更强的是_____,从原子结构角度解释原因:_____。
(5)写出右图所示过程的总反应方程式:_____。
【答案】![]() 离子键 < H—O N和O电子层数相同,核电荷数N<O,原子半径N>O,吸引电子能力N<O 2N2+6H2O
离子键 < H—O N和O电子层数相同,核电荷数N<O,原子半径N>O,吸引电子能力N<O 2N2+6H2O 4NH3+3O2
4NH3+3O2
【解析】
(1)氮原子通过三对共用电子对形成N2分子;
(2)活泼金属与活泼非金属形成离子键;
(3)非金属性越强,气态氢化物越稳定;
(4)原子半径N>O,O原子吸引电子的能力大于N;
(5)根据图示,通入氮气和水,生成氨气和氧气;
(1)氮原子通过三对共用电子对形成N2分子,N2的电子式是![]() ;
;
(2)活泼金属与活泼非金属之间易形成离子键,Li3N中含有的化学键类型是离子键;
(3)非金属性越强,气态氢化物越稳定,所以热稳定性:NH3<H2O;
(4)N和O电子层数相同,核电荷数N<O,原子半径N>O,O原子吸引电子的能力大于N,所以NH3 、H2O分子中化学键极性更强的是H—O;
(5)根据图示,通入氮气和水,生成氨气和氧气,所以总反应是2N2+6H2O 4NH3+3O2.
4NH3+3O2.


科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 2,3,3,4—四甲基戊烷的一氯代物有3种
B. 分子式为C3H2Cl6的有机物,其同分异构体(不考虑立体异构)共有4种
C. 甲烷与氯气的混合气体在光照条件下反应生成的有机化合物均无同分异构体
D. 结构简式为H3C![]() CH3的有机物,属于芳香族化合物的同分异构体有2种
CH3的有机物,属于芳香族化合物的同分异构体有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,可逆反应2NO2![]() 2NO+O2在恒容密闭容器中进行,达到平衡状态的标志是
2NO+O2在恒容密闭容器中进行,达到平衡状态的标志是
①单位时间内生成nmolO2的同时生成2nmolNO2;
②单位时间内生成nmolO2的同时生成2nmolNO;
③混合气体的密度不再改变;
④混合气体的颜色不再改变;
⑤密闭容器中压强不再改变;
A.②③⑤B.①③⑤C.①④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、J、Q五种短周期主族元素的原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3∶8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一。请回答下列问题:
(1)Q元素在周期表中的位置是_______________________________________。
(2)这五种元素的原子半径从大到小的顺序为__________________(填元素符号)。
(3)元素的非金属性:Z________Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有________(填字母)。
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与它的+4价氧化物反应的化学方程式为________________________。
(5)X与Y可形成分子A,也可形成阳离子B,A与B都是10电子构型,写出阳离子B的电子式:__________,如何检验溶液中阳离子B的存在,请说出简要的实验方法:______,A的空间构型是______;实验室制备气体A的化学方程式:_______________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对菠菜中的铁元素(主要以难溶的FeC2O4形式存在)进行检测。实验如下:
I.水煮检验法:
II灼烧检验法: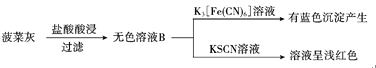
(1)CCl4的作用为______。
(2)操作i中起分离作用的仪器名称为______。
(3)溶液A中未能检测出Fe2+的可能原因是______。
(4)取无色溶液B,先滴加H2O2溶液,再滴加KSCN溶液,溶液呈红色。用离子方程式表示H2O2的作用:______。
(5)甲同学取少量无色溶液B,滴加酸性KMnO4溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有Fe2+。乙同学认为甲同学的实验方法不严谨,设计并完成如下实验:用稀硝酸溶解菠菜灰,产生的无色气体使澄清石灰水变浑浊,得到的无色溶液中滴加AgNO3溶液,产生白色沉淀(Ag2C2O4)。甲同学反思自己的方法不严谨,理由是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究KI和酸性KMnO4溶液的反应。
实验序号 | Ⅰ | Ⅱ |
实验操作 |
|
|
实验现象 | 紫色褪去,溶液变为棕黄色 | 紫色溶液迅速变为棕褐色悬浊液,然后沉淀消失,溶液变为棕黄色 |
资料:i. MnO4— 在酸性条件下最终被还原为Mn2+。ii. 酸性条件下氧化性: KMnO4>KIO3>I2 。
(1)实验1中溶液呈棕黄色,推测生成了________。
(2)实验小组继续对实验II反应中初始阶段的产物成分进行探究:

①经检验,实验II初始阶段I— 的氧化产物不是I2,则“实验现象a”为________。
②黑色固体是________。
③设计实验方案证明在“紫色清液”中存在IO3-:________。
④写出生成IO3-的离子方程式:________。
(3)探究实验II中棕褐色沉淀消失的原因。

用离子方程式解释实验II中棕褐色沉淀消失的原因:________。
(4)实验反思:KI和酸性KMnO4溶液反应过程中,所得产物成分与________有关(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含元素碲(Te)的几种物质存在如图所示转化关系。下列说法错误的是
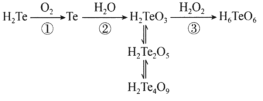
A.反应①利用了H2Te的还原性
B.反应②中H2O作氧化剂
C.反应③利用了H2O2的氧化性
D.H2Te2O5转化为H2Te4O9发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是
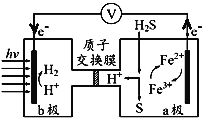
A.该装置工作时,H+由b极区流向a极区
B.该制氢工艺中光能最终转化为化学能
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com