
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。

根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为________,正反应为_____(填“吸热”或“放热”)反应。
(2)t1 min后,改变下列某一条件,能使平衡向逆反应方向移动的有______(填字母序号)。
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
【答案】A(g)+3B(g)![]() 2C(g)放热C
2C(g)放热C
【解析】
(1)随反应进行,A、B的物质的量浓度减小,为反应物,C的物质的量浓度增大,为生成物,最终A、B的浓度不变化,且不为0,属于可逆反应,A、B、C的化学计量数之比=(0.5-0.3)∶(0.7-01)∶0.4=1∶3∶2,故反应方程式为:A(g)+3B(g)2C(g);由图(Ⅱ)可知T1>T2,升高温度,B的体积分数增大,说明升高温度,平衡向逆反应方向移动,则正反应为放热反应,故答案为:A(g)+3B(g)2C(g);放热;
(2)A.保持其他条件不变,增大压强,平衡向正反应方向移动,故A错误;B 保持容器总体积不变,通入少量稀有气体,各组分的浓度不变,平衡不发生移动,故B错误;C.该反应为放热反应,升高温度,平衡向逆反应方向移动,故C正确;故答案为:C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
A. υ (C)=0.5 mol / L·s B. υ(D)=0.4 mol / L·s
C. υ(B)=0.6 mol / L·s D. υ(A)=0.15 mol / L·s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“煤制油”的关键技术是煤的气化,目前煤的气化主要是煤中的碳和水蒸气反应: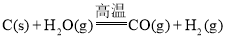 ,该反应是吸热反应,反应所需能量是由间歇进行的碳的燃烧(氧气用空气代替)来提供的:
,该反应是吸热反应,反应所需能量是由间歇进行的碳的燃烧(氧气用空气代替)来提供的: 。下列说法不正确的是( )
。下列说法不正确的是( )
A.煤的气化可以减少煤直接燃烧对环境造成的粉尘污染
B.第一个反应需要吸热,所以煤的气化从能量角度来看,得不偿失
C.煤气化后作为燃料,燃烧充分,热利用率高
D.上述两个反应,反应后的混合气体中除去![]() 、
、![]() 后主要是合成氨的两种原料气体
后主要是合成氨的两种原料气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. 向0.1 mol·L1 Na2CO3溶液中通入适量CO2气体后:c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. 常温下,pH=6的NaHSO3溶液中:c(![]() )c(H2SO3)=9.9×107 mol·L1
)c(H2SO3)=9.9×107 mol·L1
C. 等物质的量浓度、等体积的Na2CO3和NaHCO3混合:![]() <
<![]()
D. 0.1 mol·L1 Na2C2O4溶液与0.1 mol·L1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B. 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C. 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D. 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为![]() )为原料冶炼金属铝,主要步骤包括:①将粉碎后的铝土矿溶解在氢氧化钠溶液中;②向①的所得溶液中通入过量二氧化碳,获得氢氧化铝固体;③使氢氧化铝脱水生成氧化铝;④……
)为原料冶炼金属铝,主要步骤包括:①将粉碎后的铝土矿溶解在氢氧化钠溶液中;②向①的所得溶液中通入过量二氧化碳,获得氢氧化铝固体;③使氢氧化铝脱水生成氧化铝;④……
(1)步骤④为冶炼金属铝的过程,应选择的方法是______(填序号)。
A.以C、![]() 或
或![]() 作还原剂 B.热分解法 C.利用铝热反应原理还原 D.电解法
作还原剂 B.热分解法 C.利用铝热反应原理还原 D.电解法
(2)步骤③所涉及反应的化学方程式为_____________________________________________。
(3)步骤①所涉及反应的离子方程式为_________________________________________________。
(4)步骤②至步骤③的过程中,须经过_____操作。
(5)步骤②所得溶液中含有的大量阴离子是________________(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
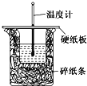
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________,烧杯间填满碎泡沫塑料的作用是________________________。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值__(填“偏大”、“偏小”或“无影响”)。
(3)实验中若改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热的数值______(填“相等”或“不相等”),理由是_______________________________。
(4)三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为2.3 ℃、2.4 ℃、2.9 ℃,则最终代入计算式的温度差的平均值为_____℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放。
(1)用化学方程式表示NO形成硝酸型酸雨的反应______
(2)能作脱除剂的物质很多,下列说法正确的是______
a.用H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
(3)尿素[CO(NH2)2]在一定条件下能有效将NOx转化为N2
Ⅰ.已知可通过下列方法合成尿素:2NH3(g)+CO2(g)![]() H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
①尿素释放出NH3的热化学方程式是______。
②写出有利于尿素释放NH3的条件并说明理由______。
ⅡCO(NH2)2与某种烟气![]() 主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
①曲线a对应CO(NH2)2与NO的物质的量比值是______。
②曲线a、b、c中,800℃~900℃区间内发生主要反应的化学方程式是______。
③900℃~1200℃区间内脱除率下降,NO浓度上升,发生的主要反应是______。
④曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为______mg/(m3·s) 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学原理的相关知识填空。
⑴常温时,![]() 的水溶液呈酸性,原因是
的水溶液呈酸性,原因是![]() 用离子方程式表示
用离子方程式表示![]() :___________,将
:___________,将![]() 溶液蒸干,灼烧,最后得到的固体产物主要是__________
溶液蒸干,灼烧,最后得到的固体产物主要是__________![]() 填化学式
填化学式![]() 。
。
⑵向![]() 溶液滴加石蕊溶液后变红,则
溶液滴加石蕊溶液后变红,则![]() 的电离程度______其水解程度
的电离程度______其水解程度![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]() 。该物质能_______
。该物质能_______![]() 填“促进”或“抑制”
填“促进”或“抑制”![]() 水的电离。
水的电离。
⑶若想除去![]() 溶液中混有
溶液中混有![]() 杂质,则往往加入试剂 ________。
杂质,则往往加入试剂 ________。
![]()
![]()
![]()
![]()
⑷泡沫灭火器的灭火原理为___________![]() 用离子方程式解释
用离子方程式解释![]()
⑸在苏打溶液中存在的电荷守恒式为__________;质子守恒式为__________
⑹常温下,物质的量浓度相同的下列溶液:![]()
![]()
![]()
![]()
![]() 溶液中
溶液中![]() 从大到小排列顺序为________
从大到小排列顺序为________![]() 填序号
填序号![]() 。
。
⑺现有a.醋酸、b.盐酸、c.硫酸三种溶液,根据要求答题。
![]() 若它们物质的量浓度相等,它们的pH由大到小的关系为_______(用abc表示,下同)。
若它们物质的量浓度相等,它们的pH由大到小的关系为_______(用abc表示,下同)。
![]() 若它们的pH相等,它们物质的量浓度由大到小的关系为_____。
若它们的pH相等,它们物质的量浓度由大到小的关系为_____。
![]() 若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为________。
若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com