
【题目】某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴滴加1mol/L的NaOH溶液至过量,下列关系图正确的是( )
A.
B.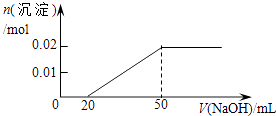
C.
D.
【答案】C
【解析】解:含MgCl2和AlCl3各0.01mol,向其中逐滴加入1mol/L的NaOH溶液至过量,发生反应Al3++3OH﹣═Al(OH)3↓,得到沉淀0.01mol,消耗氢氧化钠0.03mol,即30mL,Mg2++2OH﹣═Mg(OH)2↓,得到次沉淀0.01mol,消耗氢氧化钠0.02mol,即20mL,随反应进行沉淀量增大,共消耗氢氧化钠50mL,0.01mol氢氧化铝会溶于过量的氢氧化钠中,Al(OH)3↓+OH﹣═AlO2﹣+2H2O,消耗氢氧化钠10mL,故沉淀达最大值后,再加氢氧化钠,沉淀量减小,直到最后剩余的是氢氧化镁沉淀0.01mol.故选C.
AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,溶液为NaCl溶液,继续滴加NaOH溶液直至过量,氢氧化铝与NaOH反应逐渐溶解,再继续滴加NaOH溶液时,氢氧化铝 会完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程上,其首要原因是( )
A. 利用电池外壳的金属材料
B. 回收其中石墨电极
C. 防止电池中汞、镉和铅等重金属离子对水和土壤的污染
D. 不使电池中泄漏的电解液腐蚀其他物品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是( )
A. 苯、溴的四氯化碳、铁粉混合制成溴苯
B. 通入酸性高锰酸钾溶液可除去甲烷中的少量乙烯
C. 用溴水可鉴别苯、CCl4、己烯
D. 加入饱和的碳酸钠溶液除去乙醇中的乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C三种烃,已知:
①B完全燃烧的产物n(CO2):n(H2O)=2:3.
②C为饱和链烃,通常状况下呈气态,其二氯代物有三种.
③A是B分子中的氢原子全部被C分子中的最简单的烃基取代的产物;A遇Br2的CCl4溶液不褪色,其一氯代物只有一种.
试回答下列问题:
(1)B的分子式 , 二溴代物有种.
(2)C的三种二氯代物的结构简式为、  、 .
、 .
(3)A的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)电子工业常用FeCl3溶液做腐蚀液制造印刷电路板。用FeCl3做腐蚀液与Cu反应的原理为:2FeCl3+Cu=2FeCl2+CuCl2将一定量铁粉和铜粉的混合物放入等浓度的FeCl3和CuCl2的混合溶液中,可发生多个反应,其中首先发生反应的离子方程式为:。
(2)某校研究性学习小组用已生锈(Fe2O3)的废铁屑制作印刷电路板的腐蚀液(FeCl3溶液),并将刻蚀电路板后的废液再生为FeCl3溶液循环使用。实验流程如下: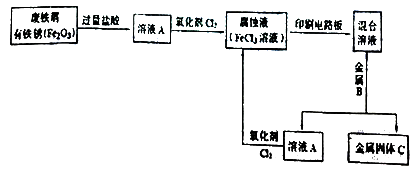
请根据使用流程写出下列反应的离子方程式:
溶液A→腐蚀液:。
混合溶液+金属B→金属固体C:。
(3)检验腐蚀液中Fe3+存在的常用试剂是 , 证明Fe3+存在的现象是。
(4)取适量混合溶液于试管中,加入一定量的铁粉,若反应结束后试管中仍有少量固体,则固体中一定含有 , 溶液中可能含有的金属阳离子是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动小组利用下图装置验证NO的还原性及探究工业生产硝酸的原理. 
(1)如何检查该装置气密性 .
(2)向广口瓶①中通入NO并测定NO的体积
通入NO前,向广口瓶①中加入水,让水充满广口瓶①,且调节滴定管中液面与①相平并记录滴定管的刻度.
从导管a通入一定量的NO并准确测定通入NO的体积的主要操作:;计算出通入的NO的体积为VmL(V<50mL).
(3)验证NO的还原性;探究工业生产硝酸的原理
A、停止通入NO后关闭K1、K3 , 打开K2 , 从导管b缓缓通入O2 , 写出通入O2过程中发生的化学反应方程式;
B、继续通入O2 , 打开K3并及时调整滴定管③液面与广口瓶①中液面相平.
Ⅰ.当通入氧气的体积为 ![]() 时,则广口瓶①的气体体积为;
时,则广口瓶①的气体体积为;
Ⅱ.当广口瓶①的气体体积为 ![]() ,则通入氧气的体积可能为 .
,则通入氧气的体积可能为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源. 
(1)黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步: ①a反应中每生成1molFeSO4转移电子的物质的量为mol.
②d反应的离子方程式为 .
(2)用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示: ①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是 .
②火法冶铜时,由Cu2S制得铜的化学方程式是 .
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.
相关反应 | 反应热 | 平衡常数 |
FeS2(s)+H2(g)FeS(s)+H2S(g) | △H1 | K1 |
| △H2 | K2 |
FeS(s)+H2(g)Fe(s)+H2S(g) | △H3 | K3 |
①上述反应中,△H10(填“>”或“<”).
②提高硫的脱除率可采取的措施有(举1例).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图装置探究SO2的性质. 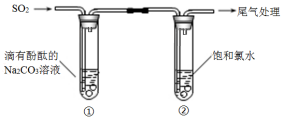
下列有关反应的方程式,不正确的是( )
A.①中溶液显红色的原因:CO32﹣+H2OHCO3﹣+OH﹣
B.①中溶液红色褪去的原因:2SO2+CO32﹣+H2O═CO2+2HSO3﹣
C.②中溶液显黄绿色的原因:Cl2+H2O═HCl+HClO
D.②中溶液黄绿色褪去的原因:SO2+Cl2+2H2O═H2SO4+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质被略去.常温常压下,A为无色有毒气体,B为红棕色粉末,C,E为金属单质,G,J的焰色均为黄色.反应①为炼铁高炉中的重要反应;反应②可用于焊接铁轨. 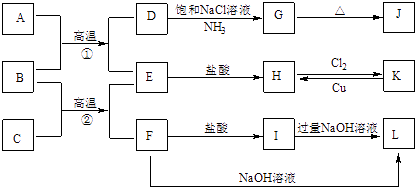
请回答下列问题:
(1)B的化学式为 , J的化学式为 .
(2)工业上将氯气通入石灰乳中制取漂白粉,该反应的化学反应方程式为 .
(3)D→G是侯氏制碱法的主要反应,该反应的化学方程式为 .
(4)K→H是制作印刷电路板的重要反应,该反应的离子方程式为 .
(5)F→L是铝土矿提纯中的重要反应,该反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com