
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
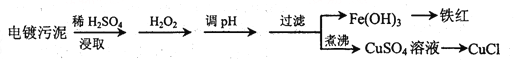
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是________________,调pH的最适宜范围为________________。
(2)调pH过程中加入的试剂最好是___________。
A. NaOH B. CuO C.NH3·H2O D.HCl
(3)煮沸CuSO4溶液的原因是_________。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式_________。
(4)过滤后的沉淀表面通常附着有一些杂质离子,为得到纯净产物,需要进行洗涤,确定沉淀洗涤干净的操作及现象是_________。
(5)称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数__________。
【答案】 将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离 3.2-4.4 B 除净溶液中的H2O2,避免影响下一步CuCl的生成 2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4 取最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,未洗涤干净,反之洗涤干净 99.50%
【解析】(1)电镀污泥中含有铜、铁等金属化合物,酸浸后主要是溶解铜、铁等金属化合物,双氧水有强氧化性,能氧化还原性的物质,Fe2+具有还原性,酸浸后加入H2O2,Fe2+能被双氧水氧化为高价离子,便于调整pH值与Cu2+分离,调pH步骤中加入的试剂最好是加入某种物质除去溶液中的酸且不引进新的杂质,所以要加入氧化铜或氢氧化铜或碳酸铜,当溶液的pH值4.4时,铜离子开始出现沉淀,当溶液的pH值为3.2时,三价铁离子沉淀完全,铜离子未产生沉淀,从而使三价铁离子和铜离子分离,因此调pH的最适宜范围为3.2~4.4;(2)根据以上分析可知调pH过程中加入的试剂最好是氧化铜,答案选B;(3)过氧化氢加热分解为水和氧气,将溶液中过量的H2O2除去可避免影响下一步CuCl的生成;因为CuSO4中+2价的铜能把Na2SO3中+4价的硫氧化成+6价的硫,向CuSO4溶液中加入一定量的NaCl、Na2SO3时生成白色的CuCl沉淀,反应的化学方程式为2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4;(4)过滤后的沉淀表面通常附着有硫酸根离子,因此确定沉淀洗涤干净的操作及现象是取最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,未洗涤干净,反之洗涤干净;(4)设样品中CuCl的质量为x,有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+,则由化学反应方程式可知:
CuCl~~~Fe2+~~~Ce4+
1 1
n(CuCl) 25.00×10-3L×0.1000 mol/L
所以n(CuCl)=2.50×10-3mol,则该样品CuCl的质量为2.50×10-3mol×99.5g/mol=0.24875g,所以0.2500g该样品CuCl的质量分数为0.24875g/0.2500g×100%=99.50%。


科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。对于浓度均为0.1 mol·L1的NaHSO3溶液和NaHCO3溶液,溶液中各微粒的物质的量浓度关系正确的是(R表示S或C) ( )
A. 两溶液中均有c(Na+) > c(![]() ) > c(H+) > c(
) > c(H+) > c(![]() ) > c(OH)
) > c(OH)
B. 两溶液中均有c(Na+) + c(H+) = c(![]() ) + c(
) + c(![]() ) + c(OH)
) + c(OH)
C. 两溶液中均有c(H+) + c(H2RO3) = c(![]() ) + c(OH)
) + c(OH)
D. 两溶液中c(Na+)、c(![]() )、c(
)、c(![]() )分别对应相等
)分别对应相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铜跟稀硝酸反应:3Cu+ 8H++2NO![]() ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
B. 实验室用大理石和稀盐酸制取CO2:2H+ + CO![]() ===CO2↑+ H2O
===CO2↑+ H2O
C. 金属铁与醋酸反应:Fe+2H+===Fe2+ + H2↑
D. 钠与水反应: Na+H2O===Na++OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将定量的Na2CO3和NaHCO3的混合物加热到不再放出气体时,收集到CO2aL,冷却后向残余物中加入足量盐酸又收集到CO2 2 aL (体积均在标准状况下测定)。则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电反应方程式为4Na+3CO2 =2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中错误的是( )
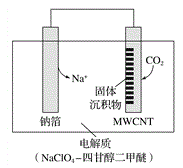
A. 电流流向为:MWCNT→导线→钠箔
B. 放电时,正极的电极反应式为 3CO2+4Na++4e-===2Na2CO3+C
C. 原两电极质量相等,若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为11.2g
D. 选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于NH4Cl的化学用语正确的是
A. 氯离子的结构示意图: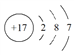
B. 其溶液呈酸性的原因:NH4Cl + H2O NH3·H2O +HCl
C. 工业上“氮的固定”:NH3 + HCl = NH4Cl
D. 比较微粒半径:N>Cl->H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为原子半径依次增大的四种短周期主族元素,其中元素a的最高正价与最低负价的代数和等于0,b、c能形成摩尔质量相同的两种单质,b、d则能化合成淡黄色的固体。下列有关判断不正确的是
A. 核电荷数大小:c>d>b>a
B. 简单氢化物的热稳定性:b>c
C. b能分别与a、c、d形成具有漂白性的物质
D. c与a形成的化合物分子中,各原子均达到8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com