
【题目】下列离子方程式书写正确的是( )
A. 铜跟稀硝酸反应:3Cu+ 8H++2NO![]() ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
B. 实验室用大理石和稀盐酸制取CO2:2H+ + CO![]() ===CO2↑+ H2O
===CO2↑+ H2O
C. 金属铁与醋酸反应:Fe+2H+===Fe2+ + H2↑
D. 钠与水反应: Na+H2O===Na++OH-+H2↑
科目:高中化学 来源: 题型:
【题目】资料表明:赤热铜能与NO2反应。某小组设计了如下实验装置进行探究,探究固体产物的成分,气体产物是N2还是NO。
已知:酸性KMnO4溶液能氧化NO生成NO3ˉ;
NO和FeSO4溶液反应:NO+FeSO4=[Fe(NO)]SO4(棕色);
Cu2O+2H+=Cu+Cu2++H2O
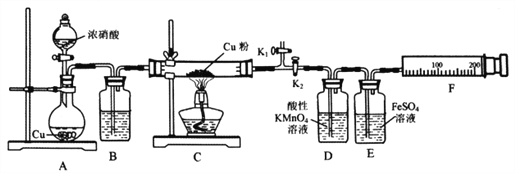
请回答下列问题:
(1)A中反应的化学方程式为________________________。
(2)检查装置气密性,装好药品,然后实验的正确操作顺序是____________
①关闭K1,打开K2 ②打开分液漏斗活塞
③打开K1,关闭K2 ④点燃C处酒精灯
(3)实验过程中,D装置中的现象是____________,能否根据D装置中的现象确认C中有无NO生成? ______,理由是________________________。
(4)E装置的作用是____________。
(5)当铜粉完全反应后,实验小组对反应后的固体成分提出以下猜想:①只有CuO;②只有Cu2O;有同学认为可通过简单的定性实验即可判断猜想①是否成立,其实验方法是_____________________。
(6)实验中E装置自始至终未显棕色,小组最后通过定量实验得到如下数据。
C装置质量 | F装置气体的体积(已折算为标准状况) | ||
玻管质量 | Cu质量 | 反应后(玻管+生成物) | |
mg | 1.92g | (m+2.24)g | 112mL |
据此写出实验时实际发生反应的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石英砂岩,是硅石中的一种,其主要化学成分可简单表示为MgAl4Si10O26(OH)2(假设杂质均能溶于硫酸),工业上拟用该物质为原料制备高纯度硅,其艺流程如图所示:
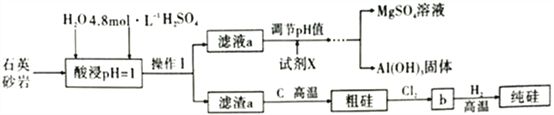
(1)请将石英砂岩的组成用氧化物的形式表示:________________,酸浸时,为了提高浸取率可采取的措施有______________________________________。(答出两点)
(2)实验室用18.4mol·L-1的浓硫酸配制250mL4.8mol·L-1的硫酸,需量取浓硫酸_______mL(结果保留一位小数);配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需__________________________。
(3)制备高纯硅的过程中需要用到Cl2,请写出实验室制备Cl2的离子反应方程式:______________。
(4)请写出b和H2反应的化学方程式,并用单线桥法表示该反应过程中电子的转移:_______________。
(5)通过实验测得滤液a中c(Al3+)=1.0mol·L-1,c(Mg2+)=0.28mol·L-1,某同学打算通过调节溶液的pH值使Al3+和Mg2+完全分离(当离子浓度降到1.0×10-6mol·L-1时即视为完全分离),则试剂X用_______(填“0.1mol·L-1NaOH或“0.1mol·L-1氨水”)较好;沉淀时应控制溶液的pH值的取值范围为_______(已知:KspAl(OH)3=8.0×10-33,Ksp[Mg(OH)2]=2.8×10-11,lg2=0.3,lg5=0.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol SO2、1 mol O2混合于2 L的恒容密闭容器中,发生反应2SO2(g) + O2(g) ![]() 2SO3(g) ΔH,2 min末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
2SO3(g) ΔH,2 min末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
(1)能证明反应已经达到平衡状态的是________。
① c(SO2)∶c(O2)∶c(SO3) = 2∶1∶2
②单位时间内生成n mol SO3的同时消耗n mol SO2
③反应速率v(SO3) = 2v(O2)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(2)下图表示该反应的速率(v)随时间(t)变化的关系:
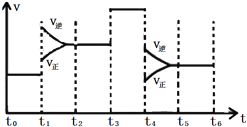
据图分析;t3时改变的外界条件可能是________;t6时保持体积不变向体系中充入少量He,平衡________(填“向左”“向右”或“不”)移动。SO2含量最高的区间是______(填“t0~t1”、“t2~t3”、“t3~t4”或“t5~t6”)。
(3)300 ℃时,该反应的平衡常数为________,若升高温度该反应的平衡常数减小,则ΔH___0(填“大于”、“小于”或“不确定”)。
(4)如果在相同条件下,上述反应从逆反应方向开始进行,开始时加入SO2 0.6 mol、SO3 1.4 mol,若使平衡时各物质的量浓度与原来平衡相同,则还应加入O2________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为__mol·L-1 (保留1位小数)。
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(ClO-)_________mol·L-1(不考虑ClO-的水解)。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法不正确的是________(填字母)。
A.如下图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.将称量好的NaClO固体在烧杯中溶解后应立即转入容量瓶
C.定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量NaClO固体的质量为149.0g
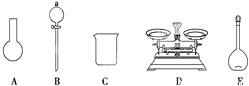
(4)该同学对容量瓶及其使用方法的认识中正确的是_______(填字母)。
A.容量瓶上标有容积、温度和浓度
B.使用前要检查容量瓶是否漏液
C.容量瓶用蒸馏水洗净后,须烘干后再使用
D.配制溶液过程中,容量瓶内液体只需要一次摇匀过程
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用18.4mol·L-1 的浓硫酸配制2L2.3molL﹣1的稀硫酸用于增强“84消毒液”的消毒能力,需用浓硫酸的体积为_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中加入氯化钡溶液生成白色沉淀,再加入稀硝酸沉淀不溶解也无气体逸出,则这种溶液中( )
A.一定含有SO42﹣
B.一定含有Ag+
C.可能不含CO32﹣
D.可能含有SO42﹣或Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
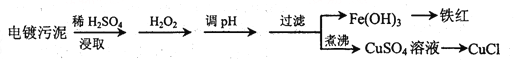
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是________________,调pH的最适宜范围为________________。
(2)调pH过程中加入的试剂最好是___________。
A. NaOH B. CuO C.NH3·H2O D.HCl
(3)煮沸CuSO4溶液的原因是_________。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式_________。
(4)过滤后的沉淀表面通常附着有一些杂质离子,为得到纯净产物,需要进行洗涤,确定沉淀洗涤干净的操作及现象是_________。
(5)称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是:
A. 某离子M层上和L层上的电子数均为K层的4倍
B. Cl-的结构示意图: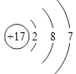
C. 某物质的焰色反应为黄色,某物质一定为钠的化合物
D. 14C和14N的质量数相等,互称为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com