
【题目】石英砂岩,是硅石中的一种,其主要化学成分可简单表示为MgAl4Si10O26(OH)2(假设杂质均能溶于硫酸),工业上拟用该物质为原料制备高纯度硅,其艺流程如图所示:
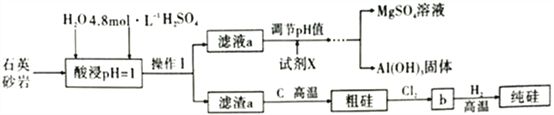
(1)请将石英砂岩的组成用氧化物的形式表示:________________,酸浸时,为了提高浸取率可采取的措施有______________________________________。(答出两点)
(2)实验室用18.4mol·L-1的浓硫酸配制250mL4.8mol·L-1的硫酸,需量取浓硫酸_______mL(结果保留一位小数);配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需__________________________。
(3)制备高纯硅的过程中需要用到Cl2,请写出实验室制备Cl2的离子反应方程式:______________。
(4)请写出b和H2反应的化学方程式,并用单线桥法表示该反应过程中电子的转移:_______________。
(5)通过实验测得滤液a中c(Al3+)=1.0mol·L-1,c(Mg2+)=0.28mol·L-1,某同学打算通过调节溶液的pH值使Al3+和Mg2+完全分离(当离子浓度降到1.0×10-6mol·L-1时即视为完全分离),则试剂X用_______(填“0.1mol·L-1NaOH或“0.1mol·L-1氨水”)较好;沉淀时应控制溶液的pH值的取值范围为_______(已知:KspAl(OH)3=8.0×10-33,Ksp[Mg(OH)2]=2.8×10-11,lg2=0.3,lg5=0.7)。
【答案】 .MgO·2Al2O3·10SiO2·H2O 加热或适当增大H+的浓度或将矿石粉碎 65.2 250mL容量瓶、胶头滴管 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O 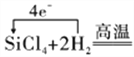 Si+4HCl 0.1mol·L-1氨水 [5.3,9.0)
Si+4HCl 0.1mol·L-1氨水 [5.3,9.0)
【解析】(1)MgAl4Si10O26(OH)2用氧化物的形式表示为MgO·2Al2O3·10SiO2·H2O,酸浸时,为了提高浸取率,可以改变适当的条件,采取的措施通常有加热或适当增大H+的浓度或将矿石粉碎,故答案为:MgO·2Al2O3·10SiO2·H2O;加热或适当增大H+的浓度或将矿石粉碎;
(2)根据稀释后硫酸的物质的量不变,需量取浓硫酸的体积=![]() =0.0652L=65.2 mL,配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需250mL容量瓶、胶头滴管,故答案为:65.2;250mL容量瓶、胶头滴管;
=0.0652L=65.2 mL,配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需250mL容量瓶、胶头滴管,故答案为:65.2;250mL容量瓶、胶头滴管;
(3)实验室通常用浓盐酸与二氧化锰加热制备Cl2,反应的离子反应方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)根据流程图,粗硅与氯气反应生成四氯化硅,四氯化硅和H2反应生成硅和氯化氢,反应的化学方程式为SiCl4 + 2H2![]() 4HCl + Si,反应过程中电子的转移用单线桥法表示为
4HCl + Si,反应过程中电子的转移用单线桥法表示为![]() Si+4HCl,故答案为:
Si+4HCl,故答案为:![]() Si+4HCl;
Si+4HCl;
(5)由于氢氧化铝是两性氢氧化物,能够溶于过量的氢氧化钠溶液,因此选用0.1mol·L-1氨水较为合理;当开始沉淀Mg2+时,c(OH-)= =
=![]() =
=![]() =1.0×10-5mol·L-1,pH=9.0,当完全沉淀Mg2+时,c(OH-)=
=1.0×10-5mol·L-1,pH=9.0,当完全沉淀Mg2+时,c(OH-)=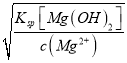 =
=![]() =
=![]() =
=![]() ×10-3mol·L-1,pH在11~12之间,当开始沉淀Al3+时,c(OH-)=
×10-3mol·L-1,pH在11~12之间,当开始沉淀Al3+时,c(OH-)=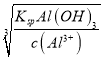 =
==2.0×10-11mol·L-1,pH=3.3,当完全沉淀Al3+时,c(OH-)=
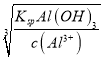 =
=![]() =2.0×10-9mol·L-1,pH=5.3,因此调节溶液的pH值使Al3+和Mg2+完全分离,需要控制溶液的pH值在[5.3,9.0) ,故答案为:0.1mol·L-1氨水;[5.3,9.0)。
=2.0×10-9mol·L-1,pH=5.3,因此调节溶液的pH值使Al3+和Mg2+完全分离,需要控制溶液的pH值在[5.3,9.0) ,故答案为:0.1mol·L-1氨水;[5.3,9.0)。


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】向盛有氯化铁溶液的烧杯中加入过量的铜粉,反应结束后,溶液中大量存在的金属离子是( )
A.Fe2+、Fe3+
B.Fe2+、Cu2+
C.Fe3+、Cu2+
D.Cu+、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某溶液中所含离子的鉴别,下列判断正确的是 ( )
A. 加入浓NaOH溶液并加热,生成的气体能使湿润的红色石蕊试纸变蓝,可确定含NH4+
B. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32-
C. 加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+
D. 加入Ba(NO3)2溶液生成白色沉淀,加稀盐酸沉淀不溶解,可确定有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。对于浓度均为0.1 mol·L1的NaHSO3溶液和NaHCO3溶液,溶液中各微粒的物质的量浓度关系正确的是(R表示S或C) ( )
A. 两溶液中均有c(Na+) > c(![]() ) > c(H+) > c(
) > c(H+) > c(![]() ) > c(OH)
) > c(OH)
B. 两溶液中均有c(Na+) + c(H+) = c(![]() ) + c(
) + c(![]() ) + c(OH)
) + c(OH)
C. 两溶液中均有c(H+) + c(H2RO3) = c(![]() ) + c(OH)
) + c(OH)
D. 两溶液中c(Na+)、c(![]() )、c(
)、c(![]() )分别对应相等
)分别对应相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A. 容器内压强P:P甲=P丙>2P乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比 k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列几种物质:①盐酸 ②石墨 ③酒精 ④SO2 ⑤熔融KHSO4 ⑥Ba(OH)2固体 ⑦氨水⑧硝酸
(1)属于强电解质的有_____________;属于非电解质的有_____________。(填序号)
(2)⑧和铜在一定条件下可发生如下反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,酸性介质与氧化剂的物质的量之比为________;请用双线桥法分析电子转移方向和数目_______。
Ⅱ.向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式__________________________________________________ 。
(2)下列三种情况下,离子方程式与(1)相同的是______(填字母)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图中的______曲线表示(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铜跟稀硝酸反应:3Cu+ 8H++2NO![]() ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
B. 实验室用大理石和稀盐酸制取CO2:2H+ + CO![]() ===CO2↑+ H2O
===CO2↑+ H2O
C. 金属铁与醋酸反应:Fe+2H+===Fe2+ + H2↑
D. 钠与水反应: Na+H2O===Na++OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com