
����Ŀ������ij��Һ���������ӵļ��������ж���ȷ���� ( )
A. ����ŨNaOH��Һ�����ȣ����ɵ�������ʹʪ��ĺ�ɫʯ����ֽ��������ȷ����NH4+
B. ����ϡ���������ɫ���壬������ͨ�����ʯ��ˮ�У���Һ����ǣ���ԭ��Һ��һ����CO32-
C. ����̼������Һ������ɫ�������ټ����������ʧ��һ����Ba2+
D. ����Ba(NO3)2��Һ���ɰ�ɫ��������ϡ����������ܽ⣬��ȷ����![]()
���𰸡�A
��������
A.����Һ�к���笠����ӣ����Լ����Һ������ʹ֮���ɰ���������ʪ��ĺ�ɫʯ����ֽ���飬��A��ȷ��
B.ʹ����ʯ��ˮ����ǵ�Ҳ�����Ƕ�������������Һ�п��ܴ���SO32-����B����
C.��ɫ����Ҳ������̼��ƣ���������ӿ�����Ca2+����C����
D.����Һ�д�������������ӣ�����Ba(NO3)2��Һ���ɰ�ɫ��������ϡ����ʱ�����ᱵ�����������ᱵ��������Ȼ���ڣ��ʲ���ȷ����SO![]() ����D����
����D����
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ھ���ͷǾ��壬����˵������ȷ�ģ�������
A. ���ǷǾ���
B. ����ͷǾ������ۻ��������¶ȶ�����
C. �����ۻ�ʱ���ȣ��Ǿ����ۻ�ʱ������
D. �����й̶��۵㣬�Ǿ���û�й̶��۵�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ý���ʵ�飬�����������ƶϳ����۵��ǣ� ��
ѡ�� | �Լ�X | Y���Լ������� | ���� | װ�� |
A | һ���� | ��̪��Һδ��� | ���β���������� |
|
B | С�մ�ʹ��� | ʯ��ˮ����� | �����С�մ��ȶ� | |
C | �����������Ȼ�� | ��������Һ���Ȳ����������ܽ� | Ag2O�����ڰ�ˮ | |
D | �������������� | ���ۡ��⻯�غͺ�����Ļ����Һ���� | ��Ӧ������Cl2 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϱ���������ͭ����NO2��Ӧ��ijС�����������ʵ��װ�ý���̽����̽���������ijɷ֣����������N2����NO��
��֪������KMnO4��Һ������NO����NO3����
NO��FeSO4��Һ��Ӧ��NO+FeSO4=[Fe(NO)]SO4(��ɫ)��
Cu2O+2H+=Cu+Cu2++H2O
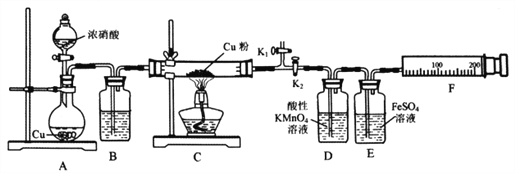
��ش��������⣺
��1��A�з�Ӧ�Ļ�ѧ����ʽΪ________________________��
��2�����װ�������ԣ�װ��ҩƷ��Ȼ��ʵ�����ȷ����˳����____________
���ر�K1����K2 ����Һ©������
����K1���ر�K2 ����ȼC���ƾ���
��3��ʵ������У�Dװ���е�������____________���ܷ����Dװ���е�����ȷ��C������NO����? ______��������________________________��
��4��Eװ�õ�������____________��
��5����ͭ����ȫ��Ӧ��ʵ��С��Է�Ӧ��Ĺ���ɷ�������²��룺��ֻ��CuO����ֻ��Cu2O����ͬѧ��Ϊ��ͨ���Ķ���ʵ�鼴���жϲ������Ƿ��������ʵ�鷽����_____________________��
��6��ʵ����Eװ����ʼ����δ����ɫ��С�����ͨ������ʵ��õ��������ݡ�
Cװ������ | Fװ����������(������Ϊ��״��) | ||
�������� | Cu���� | ��Ӧ��(����+������) | |
mg | 1.92g | (m+2.24)g | 112mL |
�ݴ�д��ʵ��ʱʵ�ʷ�����Ӧ�Ļ�ѧ����ʽ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������Һ�д���������ǣ�������
A.Ag+��K+��NO3����Cl��
B.Mg2+��Na+��Cl����SO42��
C.Ca2+��Mg2+��OH����Cl��
D.H+��Na+��CO32����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������з�����Ӧ��C(s)+CO2(g) ![]() 2CO(g)������˵������ȷ������ ��
2CO(g)������˵������ȷ������ ��
A. ����CO2Ũ�ȿ��Լӿ췴Ӧ����
B. �����¶ȿ��Լӿ췴Ӧ����
C. �����������ʱ�������г���N2����Ӧ���ʲ���
D. ����̼���������Լӿ췴Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯӢɰ�ң��ǹ�ʯ�е�һ�֣�����Ҫ��ѧ�ɷֿɼ�ʾΪMgAl4Si10O26(OH)2(�������ʾ�����������)����ҵ�����ø�����Ϊԭ���Ʊ��ߴ��ȹ裬����������ͼ��ʾ��
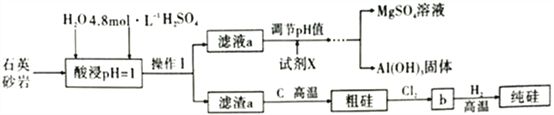
��1���뽫ʯӢɰ�ҵ���������������ʽ��ʾ��________________,���ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��______________________________________��(�������)
��2��ʵ������18.4mol��L-1��Ũ��������250mL4.8mol��L-1�����ᣬ����ȡŨ����_______mL(�������һλС��)������ʱ���ò�����������Ͳ���ձ��Ͳ������⣬����__________________________��
��3���Ʊ��ߴ���Ĺ�������Ҫ�õ�Cl2����д��ʵ�����Ʊ�Cl2�����ӷ�Ӧ����ʽ��______________��
��4����д��b��H2��Ӧ�Ļ�ѧ����ʽ�����õ����ŷ���ʾ�÷�Ӧ�����е��ӵ�ת�ƣ�_______________��
��5��ͨ��ʵ������Һa��c(Al3+)=1.0mol��L-1��c(Mg2+)=0.28mol��L-1��ijͬѧ����ͨ��������Һ��pHֵʹAl3+��Mg2+��ȫ����(������Ũ�Ƚ���1.0��10-6mol��L-1ʱ����Ϊ��ȫ����)�����Լ�X��_______(����0.1mol��L-1NaOH����0.1mol��L-1��ˮ��)�Ϻ�������ʱӦ������Һ��pHֵ��ȡֵ��ΧΪ_______(��֪��KspAl(OH)3=8.0��10-33��Ksp[Mg(OH)2]=2.8��10-11��lg2=0.3��lg5=0.7)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����BaCl2��NaCl�Ļ����ҺVL�������ֳ����ȷݡ�һ�ݵμ�ϡ���ᣬʹBa2+��ȫ��������һ�ݵμ�AgNO3��Һ��ʹCl-��ȫ��������Ӧ������amolH2SO4��bmolAgNO3����ԭ�����Һ�е�c(Na+)Ϊ
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com