
����Ŀ�����ϱ���������ͭ����NO2��Ӧ��ijС�����������ʵ��װ�ý���̽����̽���������ijɷ֣����������N2����NO��
��֪������KMnO4��Һ������NO����NO3����
NO��FeSO4��Һ��Ӧ��NO+FeSO4=[Fe(NO)]SO4(��ɫ)��
Cu2O+2H+=Cu+Cu2++H2O
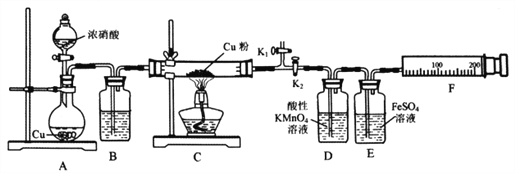
��ش��������⣺
��1��A�з�Ӧ�Ļ�ѧ����ʽΪ________________________��
��2�����װ�������ԣ�װ��ҩƷ��Ȼ��ʵ�����ȷ����˳����____________
���ر�K1����K2 ����Һ©������
����K1���ر�K2 ����ȼC���ƾ���
��3��ʵ������У�Dװ���е�������____________���ܷ����Dװ���е�����ȷ��C������NO����? ______��������________________________��
��4��Eװ�õ�������____________��
��5����ͭ����ȫ��Ӧ��ʵ��С��Է�Ӧ��Ĺ���ɷ�������²��룺��ֻ��CuO����ֻ��Cu2O����ͬѧ��Ϊ��ͨ���Ķ���ʵ�鼴���жϲ������Ƿ��������ʵ�鷽����_____________________��
��6��ʵ����Eװ����ʼ����δ����ɫ��С�����ͨ������ʵ��õ��������ݡ�
Cװ������ | Fװ����������(������Ϊ��״��) | ||
�������� | Cu���� | ��Ӧ��(����+������) | |
mg | 1.92g | (m+2.24)g | 112mL |
�ݴ�д��ʵ��ʱʵ�ʷ�����Ӧ�Ļ�ѧ����ʽ________________________��
���𰸡� Cu+4HNO3(Ũ)=Cu(NO3)2+2NO2��+2H2O �ۢڢ٢� �����ݲ������Ϻ�ɫ��Һ��ɫ��dz(��ɫ) �� NO2��H2O��Ӧ����NO(��NO2��ʹ���Ը��������Һ��ɫҲ����) �����Ƿ���NO�����NO�Ƿ������� ȡC�й������Թ��У�����������ϡ�����ַ�Ӧ����������ȫ�ܽ⣬�����ֻ��CuO 6Cu+2NO2![]() 2CuO+2Cu2O+N2
2CuO+2Cu2O+N2
����������1��A�з���ͭ��Ũ����ķ�Ӧ����ѧ����ʽΪCu+4HNO3(Ũ)=Cu(NO3)2+2NO2��+2H2O
��2�����ȴ�K1���ر�K2����Һ©��������Ӧ��ʼ���У�������NO2��װ���еĿ����Ÿɾ���Ȼ��ر�K1����K2 ����ȼC���ƾ��ƣ���ʱע��۲�D��E�е�����������ȷ˳��Ϊ�ۢڢ٢���
��3����֪������KMnO4��Һ������NO����NO3��������D�г��ֵ�����Ӧ���ǣ������ݲ������Ϻ�ɫ��Һ��ɫ��dz(��ɫ)��NO2��H2O��Ӧ����NO��NO2Ҳ��ʹ���Ը��������Һ��ɫ�����Խ�ƾ��һ������˵�� C����NO���ɣ���Ϊ�������ݲ������Ϻ�ɫ��Һ��ɫ��dz(��ɫ) ������NO2��H2O��Ӧ����NO(��NO2��ʹ���Ը��������Һ��ɫ)��
��4����֪NO��FeSO4��Һ��Ӧ��NO+FeSO4=[Fe(NO)]SO4(��ɫ)������Eװ�ÿ��Լ����Ƿ���NO�����NO�Ƿ������ꡣ
��5�������Ѿ�Cu2O+2H+=Cu+Cu2++H2O����ϡ����Լ����Ƿ���Cu2O������Cu2O���Կ�������Cu���ɣ��ʴ�Ϊ��ȡC�й������Թ��У�����������ϡ�����ַ�Ӧ����������ȫ�ܽ⣬�����ֻ��CuO��
��6��ʵ����Eװ����ʼ����δ����ɫ��˵��û������NO���Dz���Ӧ����N2��Fװ���ռ�������Ϊ������n(N2)=0.112L/22.4L/mol=0.005mol������O������=m+2.24-m-1.92=0.32g����һ�����n(O)=0.32g/16g/mol=0.02mol������n(NO2)=0.01mol�����ʵ����ȵ��ڻ�ѧ�������ȣ����Կ���д����ѧ��Ӧ����ʽΪ6Cu+2NO2![]() 2CuO+2Cu2O+N2��
2CuO+2Cu2O+N2��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�����У�û�з�����ѧ�仯���ǣ� ��
A.���Ķۻ�
B.�������
C.�������
D.ȼ���̻�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ���Ȼ�����Һ���ձ��м��������ͭ�ۣ���Ӧ��������Һ�д������ڵĽ��������ǣ� ��
A.Fe2+��Fe3+
B.Fe2+��Cu2+
C.Fe3+��Cu2+
D.Cu+��Cu2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�X��ʾij�Y��ʾX�����к��е������ӣ�Z��ʾҪ��ȥ���ʼ�����Լ���������ȷ������ǣ� ��
X | Y | Z | |
A | FeCl2 ��Һ | FeCl3 | KSCN ��Һ |
B | H2 | SO2 | NaOH ��Һ |
C | Fe2��SO4��3��Һ | FeSO4 | Cl2 |
D | SiO2 | Fe2O3 | NaOH ��Һ |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ⶨˮ���ܽ����ķ����ǣ�
����ȡa mLˮ����Ѹ�ټ���̶���MnSO4��Һ�ͼ���KI��Һ(��KOH)����������ƿ����������ʹ֮��ַ�Ӧ���䷴ӦʽΪ��2Mn2����O2��4OH��===2MnO(OH)2(�÷�Ӧ����)��
�ڲⶨ��������Ѹ�ټ���1��2 mLŨ����(�ữ���ṩH��)��ʹ֮����I2������b mol/L��Na2S2O3��Һ�ζ�(�Ե���Ϊָʾ��)������V mL���йط�ӦʽΪ��MnO(OH)2��2I����4H��===Mn2����I2��3H2O��I2��2S2O![]() ===2I����S4O
===2I����S4O![]() ��
��
�Իش�
��1���ζ��������õ��IJ�������������ʽ�ζ��ܡ���ʽ�ζ����ȱ��_____________��
��2���ζ�����ʱ�����ֿ��Ƶζ��ܣ�����________���۾�Ҫע��________��
��3��ˮ���ܽ����ļ���ʽ��______(��g/LΪ��λ)��
��4���ζ�(I2��S2O![]() ��Ӧ)�Ե���Ϊָʾ�����յ�ʱ��Һ��________ɫ��Ϊ________ɫ���Ұ�����ڲ���ɫ��
��Ӧ)�Ե���Ϊָʾ�����յ�ʱ��Һ��________ɫ��Ϊ________ɫ���Ұ�����ڲ���ɫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a��b��c��dΪ������Ԫ�أ�ԭ��������������25��ʱ��������������ˮ������Һ(Ũ�Ⱦ�Ϊ0.1mol��L-1)��pH��ԭ�������Ĺ�ϵ��ͼ��ʾ�������й�˵����ȷ����

A. �����Ӱ뾶��b>a
B. dԪ���������ˮ����һ����ǿ��
C. ��̬�⻯����ȶ��ԣ�d>c
D. b��c�ļ����Ӷ����ƻ�ˮ�ĵ���ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ij��Һ���������ӵļ��������ж���ȷ���� ( )
A. ����ŨNaOH��Һ�����ȣ����ɵ�������ʹʪ��ĺ�ɫʯ����ֽ��������ȷ����NH4+
B. ����ϡ���������ɫ���壬������ͨ�����ʯ��ˮ�У���Һ����ǣ���ԭ��Һ��һ����CO32-
C. ����̼������Һ������ɫ�������ټ����������ʧ��һ����Ba2+
D. ����Ba(NO3)2��Һ���ɰ�ɫ��������ϡ����������ܽ⣬��ȷ����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NaHSO3��Һ�����ԣ�NaHCO3��Һ�ʼ��ԡ�����Ũ�Ⱦ�Ϊ0.1 mol��L1��NaHSO3��Һ��NaHCO3��Һ����Һ�и��������ʵ���Ũ�ȹ�ϵ��ȷ����(R��ʾS��C) �� ��
A. ����Һ�о���c(Na+) > c(![]() ) > c(H+) > c(
) > c(H+) > c(![]() ) > c(OH)
) > c(OH)
B. ����Һ�о���c(Na+) + c(H+) = c(![]() ) + c(
) + c(![]() ) + c(OH)
) + c(OH)
C. ����Һ�о���c(H+) + c(H2RO3) = c(![]() ) + c(OH)
) + c(OH)
D. ����Һ��c(Na+)��c(![]() )��c(
)��c(![]() )�ֱ��Ӧ���
)�ֱ��Ӧ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����(����)
A. ͭ��ϡ���ᷴӦ��3Cu�� 8H����2NO![]() ===3Cu2����2NO����4H2O
===3Cu2����2NO����4H2O
B. ʵ�����ô���ʯ��ϡ������ȡCO2��2H�� �� CO![]() ===CO2���� H2O
===CO2���� H2O
C. ����������ᷴӦ��Fe��2H��===Fe2�� �� H2��
D. ����ˮ��Ӧ�� Na��H2O===Na����OH����H2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com