
| A. | 第一电离能:③>②>④>① | B. | 原子半径:①>②>④>③ | ||
| C. | 电负性:③>①>②>④ | D. | 最高正化合价:③>①>②>④ |
分析 由四种元素基态原子电子排布式可知,①1s22s22p63s23p4为S元素,②1s22s22p63s23p3为P元素,③1s22s22p5为F元素、④1s22s22p63s23p2是Si元素,
A、同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能降低,注意全满、半满稳定状态;
B、根据同周期自左而右原子半径减小、电子层越多原子半径越大分析判断;
C、同周期自左而右电负性增大,非金属性越强电负性越大;
D、最高正化合价等于最外层电子数,但F元素没有正化合价.
解答 解:由四种元素基态原子电子排布式可知,①1s22s22p63s23p4为S元素,②1s22s22p63s23p3为P元素,③1s22s22p5为F元素、④1s22s22p63s23p2是Si元素.
A、同周期自左而右第一电离能呈增大趋势,但P元素原子3p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,所以第一电离能Si<S<P<Cl,同主族自上而下第一电离能降低,所以第一电离能F>Cl,所以第一电离能Si<S<P<F,即:③>②>①>④,故A错误;
B、同周期自左而右原子半径减小,所以原子半径Si>P>S,电子层越多原子半径越大,所以原子半径F最小,故原子半径Si>P>S>F,即④>②>①>③,故B错误;
C、同周期自左而右电负性增大,所以电负性Si<P<S<Cl,同主族从上到下电负性减弱,所以电负性F>Cl,故电负性Si<P<S<F,即④<②<①<③,故C正确;
D、最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价:①>②>④,故D错误.
故选:C.
点评 本题考查核外电子排布规律、元素周期律等,难度不大,注意能级处于半满、全满时元素的第一电离能高于同周期相邻元素.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 每生成2分子AB吸收bkJ热量 | |
| B. | 该反应中反应物的总能量高于生成物的总能量 | |
| C. | 断裂1molA-A键和1molB-B键,放出a kJ能量 | |
| D. | 该反应焓变为△H=+(a-b) kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
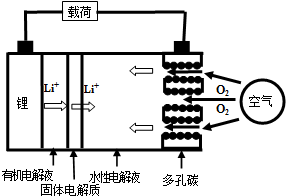
| A. | 放电时负极的电极反应式为:Li-e-=Li+ | |
| B. | 熔融的氢氧化锂用惰性电极电解再生时,金属锂在阴极得到 | |
| C. | 有机电解液可以是乙醇等无水有机物 | |
| D. | 放电时,正极的电极反应式为:2H2O+O2+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的比例模型: | B. | 氯离子的结构示意图: | ||
| C. | 溴原子的价层电子排布式:4s24p5 | D. | 过氧化钠的电子式: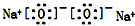 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA | |
| B. | 0.1molCmH2n+2中含有的碳碳单键数为0.1nNA | |
| C. | 2.8g乙烯和丙烯的混合气体中所含碳原子为0.2NA | |
| D. | 1mol苯乙烯中含有的碳碳双键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学进行如下实验,探究化学反应中的能量变化.通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低.
某同学进行如下实验,探究化学反应中的能量变化.通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com