
【题目】根据反应2KMnO4+16HCl(浓)=2KCl+2MnC12+5Cl2↑+8H2O填写下列各空:
(l)____________元素被还原,____________是还原剂;
(2)氧化产物与还原产物的物质的量之比为____________;
(3)用双线桥标明上述化学方程式的电子转移的方向和数目:_____________
2KMnO4+16HCl(浓)=2KCl+2MnC12+5Cl2↑+8H2O
 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.2-甲基丁烷也称异丁烷
B.由乙烯生成乙醇属于加成反应
C.C4H9Cl有3中同分异构体
D.光照条件下,甲烷通入氯水中,氯水黄绿色褪去,说明甲烷与氯水发生了取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效能原料,其原子核内的中子数为________________
(2)Na的原子结构示意图为____________________,Na的熔点比K的熔点__________(填“高”或“低”)
(3)MgCl2在工业上应用广泛,可由MgO制备。
①月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为______________________________。
②MgO与碳粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为________________________________(写化学式)。制备MgCl2 的化学方程式为
__________________________________________________________________。
③月壤中含有丰富的3He,从月壤中提炼100g 3He,同时可得600kg H2和70kg N2,若以得到的H2和N2为原料经一系列反应最多可生产碳酸氢铵____________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及化合物(或溶液)的转化关系:

已知B、C、D、E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I、J通常状况下呈气态;反应④是化工生产中的一种重要固氮反应。请回答下列问题:
(1)写出A、B元素在周期表中的位置:A__________________ B__________________
(2)①~⑥反应中属于氧化还原反应的是 ___________________________________(填序号)
(3)写出②的化学方程式: _____________________________
⑥的离子方程式:______________________________________
(4)反应⑤的现象是________,J的另一种检验方法及现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.请回答:
(1)H2O2的电子式___________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________。
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式_____________。
(4)完成以下氧化还原反应的离子方程式:
( )MnO4-+( )C2O42-+______=( )Mn2++( )CO2↑+________
Ⅱ.(12分) 化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的H2。
请推测并回答:
(1)甲的化学式__________。
(2)甲与AlCl3反应得到NaAlH4的化学方程式__________。
(3)NaAlH4与水发生氧化还原反应的化学方程式__________。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式 。
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的。
判断该同学设想的制备和验纯方法的合理性并说明理由___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017宝山区二模】在密闭容器中,反应2SO2(g)+O2(g)=2SO3(g) 达到平衡后,若将容器体积缩小一半,对反应产生的影响是( )
A.V(正)减小,V(逆)增大 B.V(正)增大,V(逆)减小
C.V(正)、V(逆)都减小 D.V(正)、V(逆)都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016湾里区模拟】在25℃、1.01×105 Pa下,反应2N2O5(g)═4NO2(g)+O2(g)△H=+56.7kJmol﹣1能自发进行的合理解释是( )
A.该反应是分解反应
B.该反应的熵增效应大于焓变效应
C.该反应是熵减反应
D.该反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
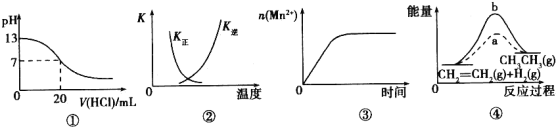
A.图①表示25℃时,用0.1 moI·L-1盐酸滴定20 mL0.l mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0, 正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH<0, 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.0l moI·L-1 KMnO4酸性溶液与过量的0.l moI·L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)![]() CH3CH3(g) △H<0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g) △H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com