
【题目】有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。请回答下列问题:
(1)C原子基态时的电子排布式为_______________,元素A、B、C、F的原子半径由大到小的顺序_________。
(2)A2F的分子空间构型为_______________,FO3分子中F原子的杂化方式______________。
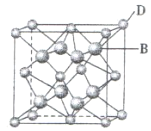
(3)从图中可以看出,D 与B形成的离子化合物的化学式为__________(用元素符号表示),该离子晶体的密度为ag·cm-3,则晶胞的体积是_________(写出表达式即可,不用化简)。
(4)已知E单质的晶体为面心立方最密堆积 (在晶胞的顶点和面心均含有一个E原子),则E的晶体中E原子的配位数为________。
(5)氮化硼(BN)是一种重要的功能陶瓷材料,其晶胞结构如图所示。请回答下列问题:
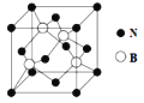
B和N相比,电负性较大的是_________,氮化硼的晶体类型______,氮化硼的晶胞中有几个氮原子_________。
【答案】1s22s22p3 或[He]2s22p3 S>N>F>H V形 sp2 CaF2 ![]() 12 N 原子晶体 4
12 N 原子晶体 4
【解析】
A是周期表中原子半径最小的元素,A为H元素;B是电负性最大的元素,B为F元素;C的2p轨道中有三个未成对电子,C的电子排布式是1s22s2sp3,C为N元素;F原子核外电子数是B 与C核外电子数之和,F是S元素;E能形成红色或砖红色E2O和黑色的EO两种氧化物,E是Cu元素;根据 D与F元素可形成离子化合物的晶胞结构图,可知D与F元素形成离子化合物化学式是DF2,D为+2价,D是主族元素且与E同周期,D是Ca元素。据此解答。
(1)C是N元素,核外有7个电子,基态时的电子排布式为1s22s22p3;电子层数越多半径越大,电子层数相同,质子数越多半径越小,元素H、F、N、S的原子半径由大到小的顺序S>N>F>H;
(2)H2S中S原子的价电子对数是4,有2对孤电子对,分子空间构型为V形,SO3分子中S原子的价电子对数是![]() ,S的杂化方式是sp2;
,S的杂化方式是sp2;
(3)根据均摊原则,Ca原子数是![]() ,F原子数是8,所以该离子化合物的化学式为CaF2,设晶胞的体积为V, ag·cm-3=
,F原子数是8,所以该离子化合物的化学式为CaF2,设晶胞的体积为V, ag·cm-3=![]() ,晶胞的体积是
,晶胞的体积是![]() ;
;
(4)根据晶胞结构可知为面心立方最密堆积,原子的配位数为12;
(5)同周期元素从左到右,电负性增大,B和N相比,电负性较大的是N,氮化硼是功能陶瓷材料,晶体类型是原子晶体,根据均摊原则,1个晶胞中氮原子有4个。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.加入合金的质量可能为6.4g
B.参加反应的硝酸的物质的量为0.1mol
C.沉淀完全时消耗NaOH溶液的体积为150mL
D.溶解合金时收集到NO气体的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往20ml1mol/L的AlCl3溶液中滴加0.2mol/L的NaOH溶液,最后有1.17克沉淀生成,则加入NaOH溶液的体积是
A.125mLB.275mLC.325mLD.450mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A.向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中,溶液中的HCO3-浓度变化是先变大后变小(溶液体积变化均忽略不计)
B.向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化是先变大后变小(溶液体积变化均忽略不计)
C.将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是:a=b
D.有含0.2 mol Na2CO3和含0.3 mol HCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中;①②两种操作生成的CO2体积之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为短周期元素,非金属元素 A 最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的 2 倍。 B在 D中充分燃烧能生成其最高价化合物 BD2。E+与D2-具有相同的电子数。 A 在 F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是____________,写出单质 F和NaOH的离子方程式____________。
(2)B、D、E 组成的一种盐中, E的质量分数为43%,其俗名为________ ,其水溶液与等物质的量的 F单质反应的化学方程式为___________________;
(3)由这些元素组成的物质,其组成和结构信息如下表:

a的化学式为_______;b与水反应的化学方程式为_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

①该反应的化学方程式为____________________________。
②从开始至2min,Z的平均反应速率为________________。
③若要提高X的转化率,请提出两条合理措施_______________________________、____________________________。
II.某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究__________、__________对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明__________,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸甲酯的催化醇解反应可用于制备甲醇和乙酸已酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
已知v正=k正·x(CH3COOCH3)·x(C6H13OH),v逆=k逆·x(CH3COOC6H13)·x(CH3OH),其中k正、k逆为速率常数(受温度影响),x为各组分的物质的量分数。反应开始时,CH3COOCH3和C6H13OH按物质的量之比1:1投料,测得338K、343K、348K三个温度下CH3COOCH3转化率(α)随时间(t)的变化关系如图所示。下列说法正确的是( )

A.该反应的△H>0
B.348K时,该反应的平衡常数为1.8
C.A、B、C、D四点中,v正最大的是D
D.在曲线①、②、③中,k正-k逆最大的曲线是①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com