
【题目】下列说法不正确的是 ( )
A.向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中,溶液中的HCO3-浓度变化是先变大后变小(溶液体积变化均忽略不计)
B.向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化是先变大后变小(溶液体积变化均忽略不计)
C.将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是:a=b
D.有含0.2 mol Na2CO3和含0.3 mol HCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中;①②两种操作生成的CO2体积之比为3∶2
【答案】C
【解析】
A. 向Na2CO3溶液中逐滴加入HCl,依次发生反应的离子方程式:CO32-+H+=HCO3-、HCO3-+H+=CO2+H2O,溶液中的HCO3-浓度变化是先变大后变小,故A正确;
B.向NaHCO3溶液中加入Ba(OH)2固体,首先生成碳酸钡和碳酸钠,继续加Ba(OH)2固体,碳酸钠转化为碳酸钡沉淀,所以CO32-的浓度变化是先变大后变小,故B正确;
C. 设Na2O和Na2O2质量都是1g,水的质量都是mg,n(Na2O)=![]() 、n(Na2O2)=
、n(Na2O2)=![]() ;氧化钠和水反应生成氢氧化钠,生成氢氧化钠的质量是
;氧化钠和水反应生成氢氧化钠,生成氢氧化钠的质量是![]() ,所得溶液的质量是(1+m)g,氢氧化钠的质量分数是
,所得溶液的质量是(1+m)g,氢氧化钠的质量分数是![]() ;Na2O2溶于水生成氢氧化钠和氧气,生成氢氧化钠的质量是
;Na2O2溶于水生成氢氧化钠和氧气,生成氢氧化钠的质量是![]() ,生成氧气的质量是
,生成氧气的质量是![]() ,所得溶液的质量是(1+m-
,所得溶液的质量是(1+m-![]() )g,氢氧化钠的质量分数是
)g,氢氧化钠的质量分数是![]() ,所以a>b,故C错误;
,所以a>b,故C错误;
D.将Na2CO3溶液逐滴滴入HCl溶液中,立即生成二氧化碳气体,二氧化碳的物质的量是0.15mol;将HCl溶液逐滴滴入Na2CO3溶液中,先生成碳酸氢钠,然后碳酸氢钠再和剩余盐酸反应生成二氧化碳,生成二氧化碳0.1mol,①②两种操作生成的CO2体积之比为3∶2,故D正确;
选C。


科目:高中化学 来源: 题型:
【题目】常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,用该溶液作展开剂分离Fe3+ 和Cu2+的装置如右图。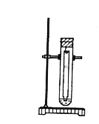
以下叙述错误的是
A.该方法为径向纸上层析法B.试样点晾干后才能补滴
C.试样点不能接触展开剂D.可喷KSCN溶液检验分离出来的Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.电解饱和食盐水时,若生成11.2LCl2,则生成H2分子的数目为0.5NA
B.28g分子式为CnH2n的链烃中含有的共用电子对数目为6NA
C.1mol晶体硅中含有的共价键数目为4NA
D.87gMnO2与100mL12mol·L-1的浓盐酸共热,转移电子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 含0.1 mol Na2O2的晶体中阳离子与阴离子总数为0.4NA
B. 46 g NO2和N2O4的混合气体中含有的氧原子数为2NA
C. 1 mol Fe与一定量硝酸恰好完全反应时,转移电子数一定为3NA
D. 1 mol CH4与过量氯气发生取代反应,生成CH3Cl气体的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是( )
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol/L) | 6 | 3 | 2 | 2 |
c(B)/(mol/L) | 5 | 3.5 | 3 | 3 |
c(C)/(mol/L) | 1 | 2.5 | 3 | 3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B![]() 2C
2C
D.在t2~t3内A的平均反应速率为:[1/(t3-t2)]mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。请回答下列问题:
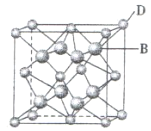
(1)C原子基态时的电子排布式为_______________,元素A、B、C、F的原子半径由大到小的顺序_________。
(2)A2F的分子空间构型为_______________,FO3分子中F原子的杂化方式______________。
(3)从图中可以看出,D 与B形成的离子化合物的化学式为__________(用元素符号表示),该离子晶体的密度为ag·cm-3,则晶胞的体积是_________(写出表达式即可,不用化简)。
(4)已知E单质的晶体为面心立方最密堆积 (在晶胞的顶点和面心均含有一个E原子),则E的晶体中E原子的配位数为________。
(5)氮化硼(BN)是一种重要的功能陶瓷材料,其晶胞结构如图所示。请回答下列问题:
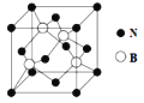
B和N相比,电负性较大的是_________,氮化硼的晶体类型______,氮化硼的晶胞中有几个氮原子_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s) + 4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.80℃达到平衡时,测得![]() ,则Ni(CO)4的平衡浓度为2mol/L
,则Ni(CO)4的平衡浓度为2mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时反应向正向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的FuNvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂lmolNN吸收167kJ热量,生成1molN≡N放出945kJ热量。根据以上信息,下列说法正确的是( )
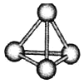
A.N4属于由非极性键构成的极性分子
B.氮元素非金属性比磷强,可知N4沸点比P4高
C.1molN4气体转变为N2气体放出888kJ热量
D.N4与N2互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F的原子序数依次增大。A原子的阴离子的电子排布式与基态锂离子的相同,A和E位于同主族,基态B原子核外有3个能级且各能级上容纳的电子数相等,基态D原子有2个未成对电子,最外能层符号为L。+1价F离子的3d能级达到全充满结构。
回答下列问题:
(1)基态C原子价电子排布图为_____。
(2)B、C、D三种元素第一电离能由大到小排序为_____(填元素符号,下同),它们的电负性由小到大排序为_____。
(3)C、F组成的晶体的晶胞如图1所示。已知该晶体密度为ρg·cm-3,NA代表阿伏加德罗常数,则C、F最近的核间距为_____cm。
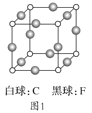
(4)A和E组成晶体,其晶胞如图2所示。E粒子周围有_____个E紧密相邻且最近;连接与E等距离且最近的A粒子构成的形状是_____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com