
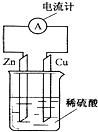
| A. | 锌片逐渐溶解 | B. | 电子由铜片通过导线流向锌片 | ||
| C. | 烧杯中溶液逐渐呈蓝色 | D. | 该装置能将电能转变为化学能 |
科目:高中化学 来源: 题型:推断题
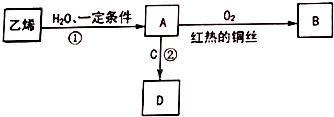 乙烯是一种重要的化工原料,可进行如图转化,其中C是食醋的主要成分.(部分反应物、生成物和反应条件已略去)
乙烯是一种重要的化工原料,可进行如图转化,其中C是食醋的主要成分.(部分反应物、生成物和反应条件已略去) CH3COOCH2CH3+H2O,反应类型是酯化反应,反应后可用饱和碳酸钠溶液除去D中混有的C.
CH3COOCH2CH3+H2O,反应类型是酯化反应,反应后可用饱和碳酸钠溶液除去D中混有的C.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHOH | B. | (CH3)2C(C2H5)OH | C. | (CH3)3CCH2OH | D. | CH3C(C2H5)2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重结晶对溶剂的要求是杂质在此溶剂中溶解度很小或很大 | |
| B. | 用重结晶法分离液态混合物时,温度越低越好 | |
| C. | 重结晶对溶剂的要求是被提纯的物质在此溶剂中的溶解度受温度的影响较大 | |
| D. | 重结晶过滤时趁热过滤并加入少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
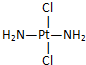 和
和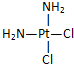 ,a具有抗癌作用而b没有,则两者互为( )
,a具有抗癌作用而b没有,则两者互为( )| A. | 同分异构体 | B. | 同素异形体 | C. | 同系物 | D. | 同种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
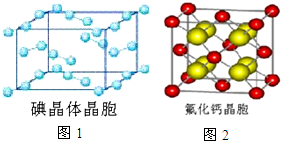 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com