
【题目】Pd/A12O3催化H2还原CO2的机理示意如图。下列说法不正确的是
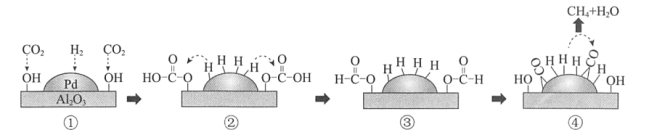
A.H-H的断裂需要吸收能量
B.①-②,CO2发生加成反应
C.④中,CO被氧化为CH4
D.生成CH4的总反应方程式是CO2+4H2![]() CH4+2H2O
CH4+2H2O
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
I.将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
能使化学反应速率加快的措施有________(填序号)。
①增加C的物质的量 ②升高反应温度
③随时吸收CO、H2转化为CH3OH ④密闭定容容器中充入CO(g)
II.工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g).
CH3OH(g).

(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________________________;
(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.写出该反应的热化学方程式___________;
(3)该反应平衡常数K为___________;
(4)恒容条件下,下列措施中能使![]() 增大的有__________;
增大的有__________;
a.升高温度 b.充入He气c.再充入2molH2 d.使用催化剂.
III. 下图是表示在一容积为2 L的密闭容器内加入2 mol的CO和6 mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系曲线:
CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系曲线:

①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是_______________。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定不同温度下0.5 mol·L-1 CuSO4溶液和0.5 mol·L-1 Na2CO3溶液pH,数据如下表:
温度/℃ | 25 | 30 | 40 | 50 | 60 |
CuSO4(aq) pH | 3.71 | 3.51 | 3.44 | 3.25 | 3.14 |
Na2CO3(aq) pH | 10.41 | 10.30 | 10.28 | 10.25 | 10.18 |
下列说法不正确的是
A. 升高温度,Na2CO3溶液中c(OH-)增大
B. 升高温度,CuSO4溶液和Na2CO3溶液的水解平衡均正向移动
C. 升高温度,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 升高温度,可能导致CO32-结合H+程度大于H2O电离产生H+程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,连二亚硫酸钠又称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如图:
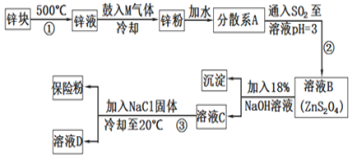
请回答下列问题:
(1)保存连二亚硫酸钠的注意事项___(任写一项)。
(2)鼓入的气体M为空气的一种主要成分,则M的电子式为___;
(3)流程②的化学方程式为__。
(4)流程③的分离方法步骤为过滤、洗涤、干燥。其中洗涤所用试剂是___;实验时加入NaCl固体的作用是__。
(5)连二亚硫酸钠可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),写出该反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯盐可导致混凝土中的钢筋腐蚀。为防止混凝土中的钢筋腐蚀,可在混凝土表面敷置一定电解质溶液并将惰性金属导电网浸泡其中,惰性金属导电网与钢筋分别连接外部直流电源从而除去Cl-,装置如图,下列说法错误的是

A. 钢筋接电源的正极
B. 金属导电网上发生的电极反应为2Cl—2e-=Cl2↑
C. 混凝土中的钙离子向钢筋方向移动
D. 电解一段时间后钢筋附近溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在自然界中存在十分广泛,在生物体内亦有极大作用,是组成氨基酸的基本元素之一。氮及其化合物在生产生活中应用广泛。氮的氢化物种类繁多,其中最重要的是氨气,液态氨是一种很好的溶剂,在许多性质方面和水非常相似。
请回答:
![]() 纯水中存在电离平衡:
纯水中存在电离平衡:![]() 。像水一样,纯液氨中也存在着微弱的电离作用,请写出液氨的电离方程式________。
。像水一样,纯液氨中也存在着微弱的电离作用,请写出液氨的电离方程式________。
![]() 金属钠可以从水中置换氢。在铁作催化剂时,金属钠也可以和液氨反应产生氢气和一种离子化合物X,该反应的化学方程式为____________________________,X的电子式是_____________。
金属钠可以从水中置换氢。在铁作催化剂时,金属钠也可以和液氨反应产生氢气和一种离子化合物X,该反应的化学方程式为____________________________,X的电子式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
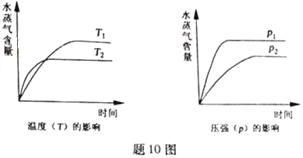
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A.Si与NaOH溶液反应:Si+2OH-+H2O===![]() +H2↑
+H2↑
B.向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++![]() +OH-===CaCO3+H2O
+OH-===CaCO3+H2O
C.电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.向含0.2 mol FeI2的溶液中滴加含0.25 mol Cl2的氯水:2Fe2++8I-+5Cl2===2Fe3++4I2+10Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com