
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
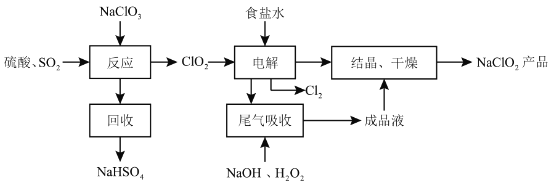
回答下列问题:
(1)NaClO2中![]() 的化合价为__________。
的化合价为__________。
(2)写出“反应”步骤中生成![]() 的化学方程式____________。
的化学方程式____________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去![]() 和
和![]() ,要加入的试剂分别为__________、__________。
,要加入的试剂分别为__________、__________。
(4)“尾气吸收”是吸收“电解”过程排出的少量![]() ,此吸收反应中,氧化剂与还原剂的物质的量之比为__________,该反应中氧化产物是____________。
,此吸收反应中,氧化剂与还原剂的物质的量之比为__________,该反应中氧化产物是____________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克![]() 的氧化能力。
的氧化能力。![]() 的有效氯含量为____________。(计算结果保留两位小数)。
的有效氯含量为____________。(计算结果保留两位小数)。
【答案】+3 2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2 NaOH溶液 Na2CO3溶液 ![]() O2 1.57
O2 1.57
【解析】
(1)根据元素化合价代数和为0计算;
(2)NaClO3在硫酸作用下与SO2反应生成ClO2和一种酸式盐,二氧化硫被氧化,应生成NaHSO4;
(3)粗盐水精制时,为除去![]() 和
和![]() ,要加入的试剂是NaOH溶液和Na2CO3溶液;
,要加入的试剂是NaOH溶液和Na2CO3溶液;
(4)ClO2与H2O2反应生成NaClO2,Cl元素的化合价降低,则H2O2中O元素的化合价升高,则反应方程为:2ClO2+ H2O2+2NaOH═2NaClO2+O2↑+2H2O,结合方程式计算;
(5)每克NaClO2的物质的量![]() =
=![]() mol,依据电子转移数目相等,可知氯气的物质的量为
mol,依据电子转移数目相等,可知氯气的物质的量为![]() mol×4×
mol×4×![]() =
=![]() mol,计算得到氯气的质量。
mol,计算得到氯气的质量。
(1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0,可得Cl的化合价为+3价,
故答案为:+3;
(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO2是氧化剂,还原产物为NaCl,回收产物为NaHSO4,说明生成硫酸氢钠,且产生ClO2,根据电子守恒可知,此反应的化学方程式为:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2,
故答案为:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2;
(3)食盐溶液中混有Mg2+和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+,
故答案为:NaOH溶液;Na2CO3溶液;
(4)依据图示可知,利用含过氧化氢的氢氧化钠溶液吸收ClO2,产物为ClO2-,则此反应中ClO2为氧化剂,还原产物为ClO2-,化合价从+4价降为+3价,H2O2为还原剂,氧化产物为O2,每摩尔H2O2失去2mol电子,依据电子守恒可知氧化剂和还原剂的物质的量之比为2:1,故答案为:2:1;O2;
(5)1gNaClO2的物质的量![]() =
=![]() mol,依据电子转移数目相等,NaClO2~Cl-~4e-,Cl2~2Cl-~2e-,可知氯气的物质的量为
mol,依据电子转移数目相等,NaClO2~Cl-~4e-,Cl2~2Cl-~2e-,可知氯气的物质的量为![]() mol×4×
mol×4×![]() =
=![]() mol,
mol,
则氯气的质量为![]() mol×71g/mol=1.57g,故答案为:1.57g。
mol×71g/mol=1.57g,故答案为:1.57g。


科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的叙述中正确的是
A. 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同
B. Na2CO3比NaHCO3热稳定性强
C. Na2CO3和NaHCO3均不可与澄清石灰水反应
D. Na2CO3和NaHCO3均可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。据图判断错误的是
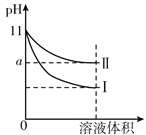
A. a大于9
B. Ⅱ为氨水稀释时溶液的pH变化曲线
C. 稀释后氨水中水的电离程度比NaOH溶液中水电离程度大
D. 完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确的是
实验① | 实验② | 实验③ |
|
|
|
A. 实验①中生成的沉淀是BaCO3
B. 实验①中有气体生成
C. 实验②沉淀中可能含有BaSO4
D. 实验③生成沉淀的离子方程式是:Ba2++ H2SO3===BaSO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是铁碳合金的总称,其强度高、价格便宜、应用广泛。在以下关于不锈钢和普通钢的认识中,你认为正确的是
A. 它们的组成元素是相同的
B. 耐腐蚀的性能不同
C. 它们都属于钢,因此物理性质相同
D. 构成普通钢和不锈钢的主要元素都是铁,因此它们的化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3—>I—,氧化性IO3—>I2。在含3molNaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如下图所示。下列说法不正确的是
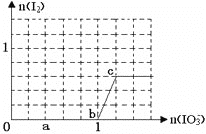
A. 0~a间发生反应:3HSO3—+IO3—=3SO42-+I—+3H+
B. a~b间共消耗NaHSO3的物质的量为1.8mol
C. b~c间反应:I2仅是氧化产物
D. 当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀。
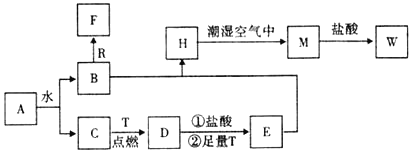
(1)物质A的化学式为_____,F化学式为____________;
(2)B和R在溶液中反应生成F的化学方程式为_____________________________;
(3)H在潮湿空气中变成M的化学方程式为_________________________________;
(4)A和水反应生成B和C的离子方程式为_________________________________;
(5)M投入盐酸中的离子方程式___________________________________________;
(6)“水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀的缘故。写出反应的离子方程式____________________________;
(7)小苏打可作胃药,请写出其中和胃酸时的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。
N在元素周期表中的位置:______________。
元素C、N最简单气态氢化物的稳定性强弱比较(填化学式): ____________.
I.氨气应用于侯德榜制碱工艺,原理如下图所示:
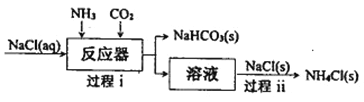
(1)过程i通入NH3和CO2的顺序是___________。
(2)过程ii有利于析出更多NH4Cl(s)的原因是_____________。
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)_________________。 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为____________。
Ⅱ.电镀工业中含CN-的废水在排放前的处理过程如下:
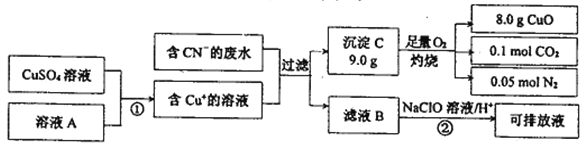
(1)溶液A具有的性质是(填“氧化性”或“还原性”) _______. C的化学式为:______。
(2)反应② 可将CN一转化为无害物质,其离子方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要用CuSO4·5H2O晶体配制500 mL 0.1 mol·L-1 CuSO4溶液,回答下列问题:

(1)应该用托盘天平称取CuSO4·5H2O________g。
(2)如图Ⅰ表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为8,量筒中液体的体积是________mL。
(3)若实验中如图Ⅱ所示的仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.定容前容量瓶底部有水珠__________________________;
B.定容时加水超过刻度线____________________________;
C.最终定容时俯视观察液面__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com